Tritium - Définition
La liste des auteurs de cet article est disponible ici.
Production
Réactions de production
Le tritium est naturellement issu de l'interaction entre le rayonnement cosmique et l'atmosphère. La réaction dominante est l'interaction entre un neutron rapide (de plus de 4 MeV) et un atome d'azote, par réaction (n,T):
Le tritium peut être abondamment produit par l'homme en bombardant du lithium par un flux neutronique. C'est le cas dans le réacteur d'une centrale nucléaire. L'isotope léger (6Li), présent dans le lithium naturel à raison de 7,5 %, capture les neutrons et donne des noyaux d'hélium et de tritium suivant la réaction :
Le lithium 7 exposé à des neutrons de haute énergie peut également subir une réaction (n, alpha) endothermique (réaction découverte lors de l'essai Castle Bravo ; explosion d'énergie 2,5 fois supérieure aux prévisions.
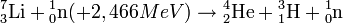 ).
).
Dans un réacteur à eau pressurisée, de l'acide borique est utilisé comme « poison » consommable. Le bore 10 peut parfois occasionnellement subir une fission ternaire (n, T, 2α), conduisant à deux atomes d'hélium et un de tritium:
Les réacteurs à eau lourde génèrent du tritium par capture d'un neutron par un atome de deutérium. Cette réaction n'a qu'une très faible section efficace (c'est pourquoi l'eau lourde est un bon modérateur) et ne produit que peu de tritium. La même réaction se produit sur la faible proportion de deutérium (0,015 %) dans les réacteurs où l'eau est utilisée comme caloriporteur.
En milieu nucléaire, l'hélium 3 produit par la désintégration du tritium est lui-même réactivé en tritium par capture neutronique, facilité par sa grande section de capture :
Le tritium est également produit dans les réacteurs nucléaires comme produit de fission, avec un rendement de l'ordre de 0,01 % (production d'un atome de tritium pour dix mille fissions). Un réacteur commercial produit ainsi chaque année 2 grammes de tritium.
Production industrielle

La principale source civile de tritium dans le monde sont les réacteur CANDU, modérés à l'eau lourde, où il constitue un produit d'activation. Dans certains réacteurs, le tritium est périodiquement extrait du modérateur, et peut être disponible pour une utilisation industrielle.
Le tritium est extrait d'eau lourde au « Tritium Removal Facility » (TRF) en deux étapes ; extraction catalytique en phase vapeur, puis distillation cryogénique. Le TRF produit annuellement 2,5 kg de tritium.
C'est la source envisagée pour le démarrage d'ITER.
Le tritium à usages militaires est produit en réacteurs d'irradiations, par irradiation de lithium. C'est la méthode choisie par l'autre grand fournisseur de tritium civil, Reviss Services et envisagée pour le fonctionnement continu d'ITER.
La fusion thermonucléaire destinée à produire de l'énergie devrait bientôt utiliser le lithium dans une zone périphérique dite de couverture, enveloppant le cœur du réacteur, pour intercepter un maximum de neutrons produits par les réactions de fusion. Le tritium ainsi produit servirait à remplacer le tritium consommé par la réaction, ce qui limiterait le transport de matières radioactives.
Métabolisme des molécules tritiées
Formes du tritium dans la biosphère
Dans l'environnement, le tritium se présente sous 3 formes principales :
- T2 (Tritium gazeux) ; HT (dihydrogène tritié) ; CHT (méthane tritié).
- HTO (Eau tritiée) : 99 % environ du tritium produit prend rapidement cette forme, essentiellement dans l'océan mondial. En 1972, l'UNSCEAR estimait à 6,3×1019 Bq, contre 4,3×1019 Bq aujourd'hui. Ce sont les océans qui en contiennent le plus, mais si dilué dans leur masse que le taux de tritium (0,2 Bq/L en moyenne) est bien plus bas que dans les eaux continentales (UNSCEAR, 1993), sauf en cas de proximité d'installations nucléaires.
- OBT (pour « Organically Bounded Tritium » ; expression désignant le tritium intégré de manière covalente au sein de molécules organiques), dans les organismes vivants (biomasse), leurs cadavres (nécromasse) ou excréments et excrétats, dans la matière organique du sol et des sédiments...
Via le recyclage de la nécromasse ou plus généralement via la chaine alimentaire, ces trois formes de tritium peuvent être transférées aux autres compartiments de l’écosystème.
Fixation biologique du tritium

Très soluble dans l'eau, il est essentiellement présent sous forme d’eau tritiée (liquide ou vapeur). On parle alors de tritium libre (par opposition au tritium incorporé dans une molécule organique, qui est dit « lié »). De même que l'hydrogène gazeux, le tritium gazeux (HT) n'est pratiquement pas métabolisé. Seul 0,01 % de l’activité inhalée est absorbé pour être ensuite oxydé rapidement en eau tritiée.
Parce que soluble dans l'eau et s'intégrant dans l'eau (eau tritiée), le tritium pénètre facilement dans les organismes par inhalation, ingestion ou à travers la peau ou les muqueuses. Le tritium ayant presque les mêmes propriétés chimiques que l'hydrogène, il s'y substitue, y compris en se liant à d'autres atomes, dans les molécules, notamment organiques, de la même manière que le ferait l'hydrogène, et l'eau tritiée se répartit sur l'ensemble du cycle de l'eau. Associé (passivement ou via le métabolisme bactérien ou d’autres espèces) à certaines molécules organiques, le tritium devient du « Tritium Organiquement Lié Echangeable » (dit TOL-E ou OBT-E) ; il s’est alors substitué a l'hydrogène de radicaux typiques (-OH, -SH, =NH, ...) et circule dans les organismes vivants en empruntant les voies de ces radicaux.
Les atomes de tritium de la fraction organique échangeable sont très labiles (liaisons covalentes faibles). Le tritium organique en position échangeable se met en fait en équilibre avec le tritium contenu dans l'eau cellulaire et subit les mêmes évolutions. Sa période biologique est donc sensiblement la même que celle de l'eau tritiée.
De la forme liée en eau tritiée, le tritium est également incorporé à la matière organique lors de la photosynthèse. Le tritium est qualifié de « Tritium Organiquement Lié Non-Echangeable » (TOL-NE ou OBT-NE) quand il s’est directement lié aux atomes de carbone des molécules organiques. Ces dernières molécules sont beaucoup plus stables car les liaisons carbone-hydrogene dont des liaisons covalentes fortes qui nécessitent une combustion ou un crackage ou une lyse enzymatique pour être cassées.
Le tritium non échangeable peut avoir un comportement très différent de celui du tritium libre ou en solution dans l’eau dans l’organisme Sous forme organique liée non échangeable (OBT), la manière dont le tritium participe au métabolisme dépend de la molécule où il s'est fixé. De ce fait, le tritium montre dans la cellules une diffusion non homogène (ce qui en toute rigueur peut conduire à un niveau de dangerosité variant avec la forme de l'OBT). Sa période radioactive de 12,3 ans lui permet d’avoir des effets sur un temps significatif du point de vue écotoxicologique. Le tritium fixé participe à l'ensemble du métabolisme, y compris l'élaboration de l'ADN : Komatsu en contaminant expérimentalement une réseau trophique constitué de diatomées (Chaetoceros gracilis) et petites crevettes (Artemia salina) et poissons (Oryzias latipes) constatait qu'une part significative de ce tritium est incorporé dans l’ADN des artémies. Cependant, sur des organismes à cycle de vie plus long, Kirchmann ne constatait pas de concentration particulière dans l’ADN.
Sous forme fixée, il n'y a plus d'échanges avec l'eau cellulaire et les autres radicaux à liaison faible. Sa période biologique n'est plus liée à celle de l'eau tritiée, mais dépend du métabolisme associé à la molécule porteuse, laquelle peut être très stable dans l'organisme. La durée de l’incorporation de tritium dépend donc du turn-over de la molécule biologique : rapide pour des molécules qui participent au cycle énergétique, plus lente pour des molécules de structure ou des macromolécules comme l’ADN, ou bien des molécules de réserve énergétique. C'est sous cette forme qu'il marque l'environnement de façon durable. C'est cette fixation qui permet par exemple de reconstituer les teneurs historiques en tritium par l'étude des cernes d'arbres.
Cinétique dans l'organisme
La période biologique (sensiblement égale à la période effective dans le cas du tritium) varie suivant la forme sous laquelle le tritium est fixé. Quelle que soit la forme de l’apport en tritium, la plus grande partie du tritium est réputée éliminée en 1 mois et la presque-totalité est éliminée en moins de 1 an. Sa période biologique est donc très inférieure à sa période radioactive.
Il est bien plus rare sous forme gazeuse que sous forme d'eau trititée. La part inhalée est réputée se répandre équitablement dans les tissus mous, et se met en équilibre avec la concentration extérieure. Le tritium gazeux est peu soluble, seul 0,01% de l’activité inhalée est transféré dans le sang sous forme d’HTO. L’assimilation sous forme de tritium gazeux est donc environ 10 000 fois plus faible que sous forme d’eau tritiée.
L'eau tritiée étant très semblable à de l'eau ordinaire, son importance en radiotoxicité dépasse celle du gaz tritium parce qu'elle est assimilée par l'organisme. L’eau tritiée suit la biocinétique de l’eau avec un équilibre rapide entre HTO et H2O. L'eau tritiée se mêle rapidement à toute l'eau du corps. L’eau tritiée diffuse librement et rapidement à travers toutes les membranes cellulaires et s’équilibre avec les fluides corporels en quelques minutes. L’eau tritiée est éliminée via la transpiration, la vapeur d'eau expirée et l'excrétion urinaire. On admet qu’en moyenne le renouvellement de l’eau libre corporelle s’effectue avec une période biologique de 10 jours chez l’adulte. Cette valeur reflète le cycle de l'eau dans l'organisme considéré. Les périodes biologiques varient en fonction de l’âge, pour la partie eau tritiée : de 3 jours à l’âge de 3 mois à 10 jours chez l’adulte. Les 3 % qui passent sous forme de tritium organique (essentiellement sous forme lié échangeable) sont éliminés avec une période de demi-vie dans l'organisme de 40 jours : chez le rat buvant une eau tritiée, 97% du tritium incorporé a une demi-vie biologique de 10 jours, et 3 % a une demi-vie de 40 jours.
Si ce sont les aliments qui sont contaminants, le tritium peut être présent sous forme d'eau (tritiée) dans les tissus, d'OBT échangeable substitué à d'autres radicaux, ou d'OBT non échangeable. La part présente sous forme d'eau tritiée s'élimine avec une demi-vie de l'ordre de dix jours. En milieu marin, l'OBT a une demi-vie de 10 jours pour 70 % du tritium incorporé, et de 100 jours pour le 30 % restant. Les molécules organiques tritiées (OBT) apportées par l’alimentation sont dégradées par la digestion et transférées dans le sang sous forme d’eau tritiée, ou sous forme de molécules organiques tritiées de plus petite taille. La plupart des composés organiques absorbés (sucres, graisses, protides) sont utilisés et dégradés pour produire de l’énergie et de l’eau tritiée et rejoint le pool d’eau cellulaire. Cette eau est ensuite partiellement recyclée dans la synthèse des protéines, hormones, lait, graisses. Sous forme organique (TBO), sa période de demie-vie est de 40 jours chez l'adulte (contre 8 jours chez le nourrisson).
Une faible proportion du total (moins de 1% du tritium absorbé) est présente sous forme organique beaucoup plus stable, avec une période biologique d'environ 450 jours (composés organiques de renouvellement lent). Le tritium lié (sous forme non échangeable) dans la matière organique est plus rare, mais plus dangereux car moins rapidement éliminé (Période de 550 jours, soit 55 fois plus que les 10 jours de séjour de l'eau tritiée).
Facteur de fixation
A l'équilibre, s'il n'y a pas de mécanisme favorisant la concentration de cette substance (ou son élimination), on s'attend à trouver la même concentration dans l'organisme et dans le milieu environnant, c'est à dire une absence de bioconcentration et un facteur de concentration égal à l'unité. Trouver un facteur différent peut être l'indice d'une bioaccumulation, mais peut également provenir d'autres causes de déséquilibre.
- Au sens strict du terme, la bioaccumulation résulte d’un phénomène d’accumulation progressive d’un contaminant ou d’une substance toxique dans un organisme, à partir de diverses sources, y compris l’atmosphère, l’eau et les aliments, jusqu’à l’obtention d’une concentration dans l’organisme supérieure à celle des sources de contamination.
- Il peut s'agir de la rémanence d'une contamination passée dans certains de ses tissus, induisant un déséquilibre apparent par rapport à la concentration actuelle du contaminant dans l’environnement, plus faible qu’autrefois.
- Il peut également s'agir d'un déséquilibre entre les différentes sources : par exemple, si le tritium est répandu dans le milieu marin sous forme OBT et est incorporé par voie alimentaire, la concentration attendue le long de la chaîne métabolique de l'OBT sera différente de celle de l'eau.
- Il peut enfin s'agir d'une migration le long de la chaîne alimentaire, les proies dont s'alimente l'organisme contaminé ayant pu croître dans un milieu distant et plus fortement contaminé que le milieu ambiant.
Dans les organismes ayant été exposés à un pic de concentration importante en tritium, le tritium sous forme de gaz ou d'eau tritiée se remet rapidement en équilibre avec l'environnement, contrairement à l'OBT. Dans les milieux à concentration variable, c'est donc sous forme organique (OBT) qu'on le trouve fixé en plus grande quantité (90 à 95 % du tritium trouvé dans les organismes marins autour de Cardiff, 80 à 90 % autour de Sellafield. Autour de Hartlepool, l'OBT constitue 70 % du tritium accumulé par les moules et sa proportion est encore plus élevée (90 %) chez les bigorneaux.
On sait depuis les années 1970 au moins que la contamination nutritionnelle par des formes organiquement liées est prépondérante. Par exemple, Rodgers en 1986 montrait chez des juvéniles de truite arc-en-ciel que la quantité (maximale à l'équilibre) de tritium organique correspondait à 80 % de la quantité de tritium ingérée. Kirchmann en 1971 montrait que sur des prairies contaminées au tritium, le lait contenait 10 fois plus de tritium organique via l'alimentation que via l'eau d'abreuvage. L'incorporation dans le lait était plus rapide par voie directe, et plus lente via l'herbe avec un maximum après 4 jours. Kirchmann constatait que chez des veaux et porcs contaminés par du tritium via diverses voies (injections intra péritonéales, ingestions d’eau tritiée, de lait, de poudre de lait et de pommes de terre), l’incorporation augmentait (5,6 fois plus chez les porcs et 15 fois plus chez les veaux) quand le tritium était présent dans la poudre de lait (comparée à la voie eau). Elle était 15,6 fois plus élevée chez les porcs nourris de pomme de terre contaminée. Des rats exposés via l'eau de boisson ou des molécules organiques (leucine, lysine, glucose, glucosamine, thymidine et uridine) bioaccumulent 4 à 9 fois plus de tritium que lié à l’eau. Komatsu en contaminant expérimentalement une réseau trophique constitué de diatomées (Chaetoceros gracilis) et petites crevettes (Artemia salina) et poissons (Oryzias latipes) constatait que la fixation du tritium est bien plus forte avec le tritium contenu dans la nourriture, que dans l’eau.
A cause de cette différence dans la période biologique, la part d’irradiation due au tritium organique est le double de celle due à l’eau tritiée. Pour en tenir compte, l'Agence Health Protection Agency, a proposé de réévalue à 6 x 10(-11)Sv.Bq(-1) le facteur de dose pour le tritium apporté par les poissons plats de la baie de Cardiff.
Bioaccumulation du tritium
La possibilité d'une bioamplification du tritum a été avancée par certaines ONG (Crii-Rad, Greenpeace, ACRO…) qui dénoncent depuis les années 1980 les larges autorisations de rejets industriels de tritium et de carbone 14, en s'appuyant sur l'idée que des organismes filtreurs (ou biointégrateurs) peuvent métaboliser ou reconcentrer de nombreux toxiques dilués dans l'environnement (Par exemple, une moule peut concentrer 700 000 fois, voire jusqu'à environ 1 million de fois, l'iode qui est si faiblement réparti en mer qu'il n'est souvent pas quantifiable dans l'eau). Affirmer l'existence d'une bioamplification (quand les études scientifiques ne mettent en évidence qu'une bioconcentration) permet à ces organisations de défendre l'idée que toute concentration dans l'environnement est potentiellement nuisible pour le sommet de la chaîne alimentaire, ce qui en fait un moyen d'augmenter l'hostilité au nucléaire par une stratégie de type FUD. De ce fait, c'est une question discutée et très polémique, notamment suite à des études publiées dans les années 2000, qui mettent en évidence dans certains organismes une concentration en tritium supérieure à celle de l'eau de mer où ils évoluent. Ainsi dans l’estuaire de la Severn et le canal de Bristol, les poissons (flet et sole) vivant au contact du sédiment et s'y alimentant étaient bien plus contaminés que le sprat, pélagique et planctonophage.
Dans le cas du tritium, cependant, l'accumulation ne porte pas sur une substance chimique, mais sur un isotope: s'il y a une bioaccumulation, elle ne peut résulter que d'une séparation isotopique, dont les rendements sont toujours faibles dans les systèmes vivants. De petites différences de comportement entre tritium et hydrogène sont néanmoins connues. Dès 1990, Alpen note que le tritium étant trois fois plus lourd que l'hydrogène et d'une taille atomique très supérieure, une discrimination biologique est envisageable, d'autant qu'on admet que les réactions enzymatiques incorporent proportionnellement moins vite le tritium que l’hydrogène et que les liaisons tritium-carbone sont plus fortes que les liaisons hydrogène-carbone : ces différences dans le métabolisme devraient impacter sa cinétique environnementale et conduire à des écarts de bioconcentration quand le métabolisme modifie la liaison hydrogène. Cependant, ces différences physico-chimiques des molécules résultantes restent très faibles : l'eau tritiée est physiquement si proches de l'eau qu'elle se comporte chimiquement comme elle dans tout son cycle, sans facteur de séparation du tritium possible ou significatif. De plus, une fois que l'atome de tritium est lié, le facteur de séparation de la molécule dans son ensemble est d'autant plus faible que la molécule est lourde.
En milieu aquatique marin et continental, il est acquis que le transfert du tritium de l’eau ambiante aux organismes aquatiques conduit très rapidement à un équilibre entre l’eau tritiée du milieu d’exposition et le tritium libre des tissus biologiques. Pour des invertébrés marins, des facteurs de concentration OBTorganisme/HTOeau supérieurs à 1 ont été relevés en diverses situations par des auteurs (cas de la baie de Cardiff notamment) ; ils peuvent s’expliquer par l’origine et la forme physico-chimique du tritium incorporé (ingestion de molécules organiques tritiées). L'IRSN considère qu'il y a situation d’« équilibre-vrai » et que le tritium ne s'accumule pas préférentiellement dans tel ou tel composant environnemental ou biologique. En France, en 2008, des membres de l'IRSN, et de la SFRP estiment que les différences entre tritium et hydrogène ne justifient pas un relèvement des seuils estimés de dangerosité. L'étude de 2 algues marines (Dunaliella bioculata & Acetabularia mediterranea) avait dès 1983 suggéré une possibilité de bioaccumulation sélective mais ce résultat non conclusif n'a pas été confirmé depuis.