Benzène - Définition
La liste des auteurs de cet article est disponible ici.
Caractérisation et propriétés physico-chimiques
Le benzène est un liquide incolore, dont l'indice de réfraction est 1,50 (proche de celui du verre). Sa viscosité est plus faible que celle de l'eau. Il est très soluble dans les solvants organiques polaires, mais sa solubilité dans l'eau est assez faible. Il possède une odeur caractéristique, avec un seuil de détection de 1,5 à 900 mg·m-3 d'air.
En spectroscopie d'absorption infrarouge, le benzène présente une bande d'absorption au voisinage de 1 500–1 600 cm-1 due aux vibrations des liaisons carbone-carbone, et plusieurs pics d'absorption entre 650 et 1 000 cm-1 dus aux vibrations des liaisons carbone-hydrogène. La position et l'amplitude de ces derniers pics donnent des informations sur les substitutions éventuelles d'atomes d'hydrogène.
En Résonance magnétique nucléaire (RMN) du proton, il présente un pic de déplacement chimique δ à 7–8 ppm.
Le benzène est un composé chimique dangereux, qui doit être manipulé et utilisé avec beaucoup de précautions. Il doit être stocké entre 15 °C et 25 °C.
Réactions chimiques utilisant le benzène
La réactivité chimique du benzène est fortement dépendante de son caractère aromatique. Par exemple, la plupart des alcènes peuvent être hydrogénés (la liaison double est transformée en liaison simple par addition d'hydrogène) sous une pression de 1 atm à température ambiante dans une réaction catalysée par le nickel. Dans le cas du benzène, cette même réaction doit être réalisée à 180 °C sous une pression de 2 000 atm. En effet, l'addition d'hydrogène fait perdre le caractère aromatique, et donc la délocalisation des électrons qui contribue à stabiliser fortement le composé. Le benzène aura donc plutôt tendance à réagir par substitution de l'hydrogène, conservant ainsi son caractère aromatique.
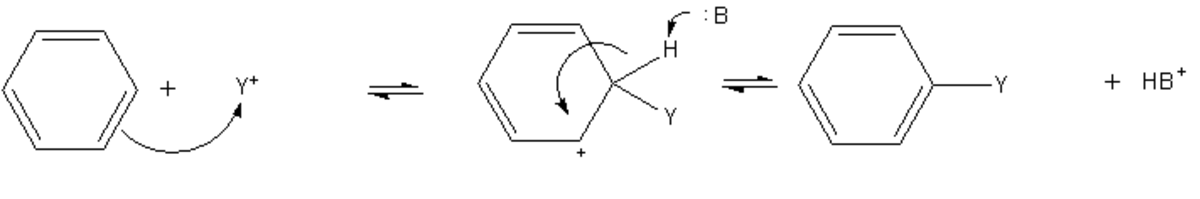
Substitution électrophile aromatique
La substitution électrophile aromatique est une réaction générique au cours de laquelle l'un des atomes d'hydrogène est substitué par un autre groupe fonctionnel. Au cours de cette réaction, le benzène joue le rôle de nucléophile, et réagit avec un réactif électrophile comme par exemple un carbocation. Le mécanisme simplifié de la réaction est le suivant :
La charge positive portée par l'intermédiaire réactionnel, nommé intermédiaire de Wheland, est en réalité délocalisée sur le cycle par mésomérie, ce qui tend à stabiliser le carbocation benzénique. Cette réaction nécessite généralement un catalyseur de type acide de Lewis.
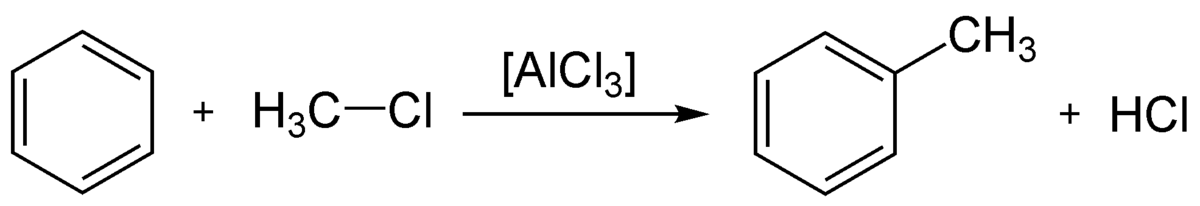
Alkylation de Friedel-Crafts
L'alkylation de Friedel et Crafts est similaire à l'acylation, à ceci près qu'elle constitue l'alkylation d'un composé aromatique, comme le benzène, par un halogénure d'alkyle. Elle est également catalysée par un acide de Lewis puissant :
Acylation de Friedel-Crafts
L'acylation de Friedel et Crafts est un cas particulier de substitution électrophile aromatique. Cette réaction est l'acylation d'un composé aromatique, comme le benzène, par un chlorure d'acyle. Cette réaction est catalysée par un acide de Lewis puissant (comme AlCl3 ici) :
Utilisations
Avant les années 1920, le benzène était fréquemment utilisé comme solvant industriel, particulièrement pour dégraisser les métaux. Lorsque sa toxicité devint évidente, il fut remplacé par d'autres solvants pour les applications nécessitant une exposition directe de l'utilisateur.
Le benzène est utilisé en majeure partie comme intermédiaire dans la synthèse d'autres composés chimiques. Les dérivés du benzène produits dans les plus grandes quantités sont le styrène, utilisé pour fabriquer des polymères et des plastiques, le phénol, utilisé pour fabriquer des résines et des adhésifs, et le cyclohexane, utilisé pour fabriquer le nylon. Des quantités moins importantes de benzène sont utilisées dans la fabrication de pneus, de lubrifiants, de colorants, de détergents, de médicaments, d'explosifs ou de pesticides. Dans les années 1980, les principaux composés produits à partir de benzène étaient l'éthylbenzène (intermédiaire pour la fabrication du styrène) avec 48 % de la consommation du benzène utilisé pour la synthèse, le cumène 18 %, le cyclohexane 15 % et le nitrobenzène 7 %.
En tant qu'additif à l'essence, le benzène permet d'augmenter l'indice d'octane, agissant donc comme antidétonant. De ce fait, jusque dans les années 1950 l'essence contenait fréquemment quelques pour cent de benzène, quand il fut remplacé par le tétraéthylplomb dans les additifs antidétonants les plus utilisés. Cependant, le benzène a fait son retour dans de nombreux pays suite aux réglementations concernant la teneur en plomb de l'essence. Aux États-Unis, les préoccupations concernant ses effets nocifs sur la santé et la possibilité de contamination des nappes phréatiques ont conduit à la mise en place d'une réglementation stricte concernant la teneur en benzène des carburants avec une limite voisine de 1 %. En Europe, cette même limite de 1 % a été fixée.