Adiabaticité - Définition
En thermodynamique, une transformation est dite adiabatique (du grec adiabatos, " qui ne peut être traversé ") si elle est effectuée sans qu'aucun échange de chaleur n'intervienne entre le système étudié et le milieu extérieur. Un tel type de transformation induit une relation entre les différents paramètres d'état du système considéré, comme la température, le volume ou la pression pour un gaz, ces quantités étant par ailleurs déjà reliées entre elles par une relation constitutuve appelée équation d'état.
Mise en pratique de l'adiabaticité
Le premier principe de la thermodynamique stipule que l'énergie est conservée. Pour un système physique interagissant avec un milieu extérieur, cela se traduit par le fait que la variation d'énergie interne au système est égale à la quantité d'énergie prise ou apportée par le milieu extérieur, que ce soit de façon ordonnée (transfert d'énergie mécanique par le travail de forces appliquées sur le système, en l'occurence les forces de pression pour un gaz), ou désordonnée par le transfert d'énergie cinétique microscopique par l'agitation thermique. Pour une transformation élémentaire (c'est-à-dire donnant lieu à une petite variation des paramètres décrivant le système), on a :
- dU = δQ + δW ,
où
- dU représente la variation d'énergie interne,
- δQ est le transfert de chaleur élémentaire sur la transformation,
- δW est le travail élémentaire des forces de pression sur la transformation.
Le transfert de chaleur δQ correspond par définition au produit de la température par la variation d'entropie. Pour un gaz parfait, ceci peut se réécrire en :
- δQ = TdS = CVdT + pdV .
Une transformation adiabatique est dite isentropique si elle est réversible, c'est-à-dire si elle se fait sans échanges de chaleur, puisqu'un échange de chaleur signifie variation d'entropie :
- δQ = 0 ,
D'où
- 0 = CVdT + pdV ,
Pour un gaz parfait, une transformation est adiabatique si la condition suivante est établie :
- pVγ = Cte ,
relation appelée loi de Laplace, où on définit l'indice adiabatique γ par
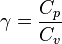 ,
,
avec
- pV = nR * T ,
où
- R * = (Cp − Cv) ,
relation dite de Mayer.
Dans ces formules,
- Cp est la capacité calorifique du gaz à pression constante
- Cv est la capacité calorifique du gaz à volume constant
- γ est déterminé par le nombre de degrés de liberté du gaz considéré (3 pour un gaz monoatomique, 5 pour un gaz diatomique, 6 pour des molécules complexes). Pour un gaz idéal monoatomique, γ = 5 / 3, et pour un gaz diatomique (azote et oxygène, les principaux composants de l'air) γ = 7 / 5.
Pour que cette loi soit valable, γ doit être constant, donc Cp et Cv aussi du fait de la relation de Mayer (cf gaz parfait) classique. Cette relation est donc applicable pour la thermodynamique de Bose-Einstein ou de Fermi-Dirac.
Autre formulation
En remplaçant les termes, on obtient pour le changement de T (température) versus p dans un changement adiabatique :
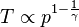 .
.
L'exposant γ étant supérieur à 1, une transformation adiabatique fait varier la pression dans le même sens que la température.
Utilisation
Un moteur thermique est un objet permetant d'échanger travail et chaleur avec un milieu extérieur. Cet échange se fait par un cycle répété de nombreuses fois. Dans ce cycle, se produit une série de transformations thermodynamiques. Parmi ces transformations, certaines sont adiabatiques. Par exemple, le cycle de Carnot correspond à un ensemble de deux transformations adiabatiques et deux transformations isothermes. Durant le cycle, le gaz subit une compression et une détente adiabatiques, ainsi qu'une compression et une détente isothermes.
