Verre - Définition
La liste des auteurs de cet article est disponible ici.
Science
Physico-chimie
Cette partie aborde le verre et ses caractéristiques d’un point de vue physico-chimique. Dans cette partie, nous limiterons notre étude à des verres d’oxydes. Cependant, il existe d’autres grands types de verres, en particulier, les verres métalliques (composés uniquement d’éléments métalliques) et les verres de spin (composés cristallisés caractérisés par une absence d’ordre magnétique à grande distance, d’où leur nom).
Structure
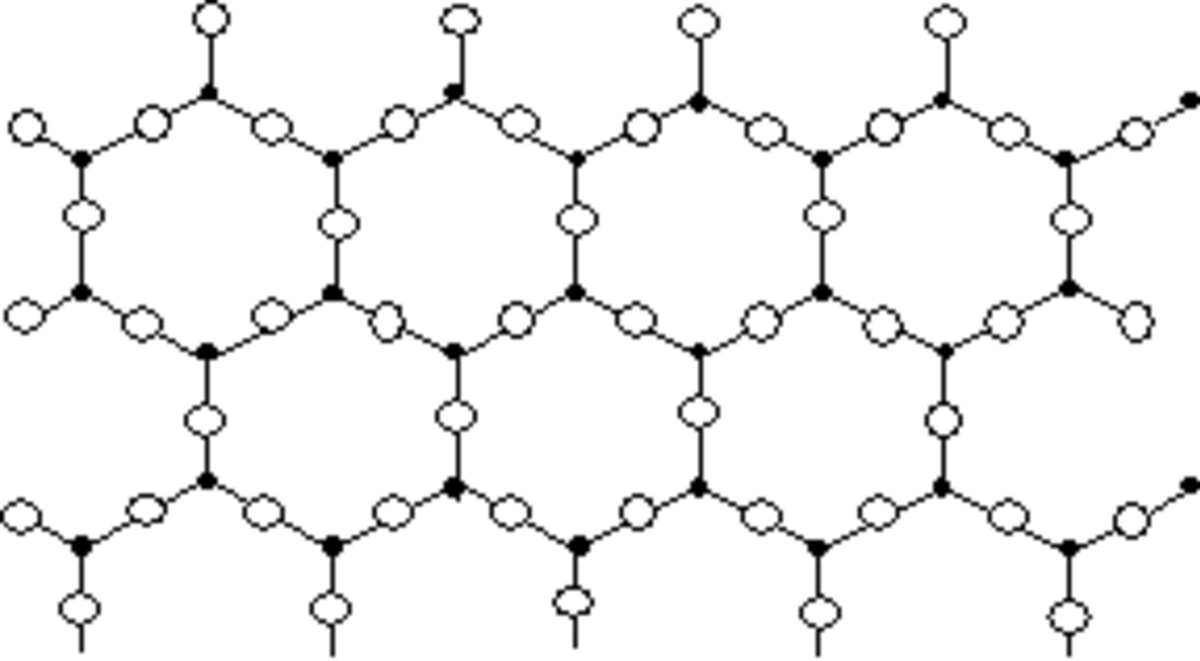
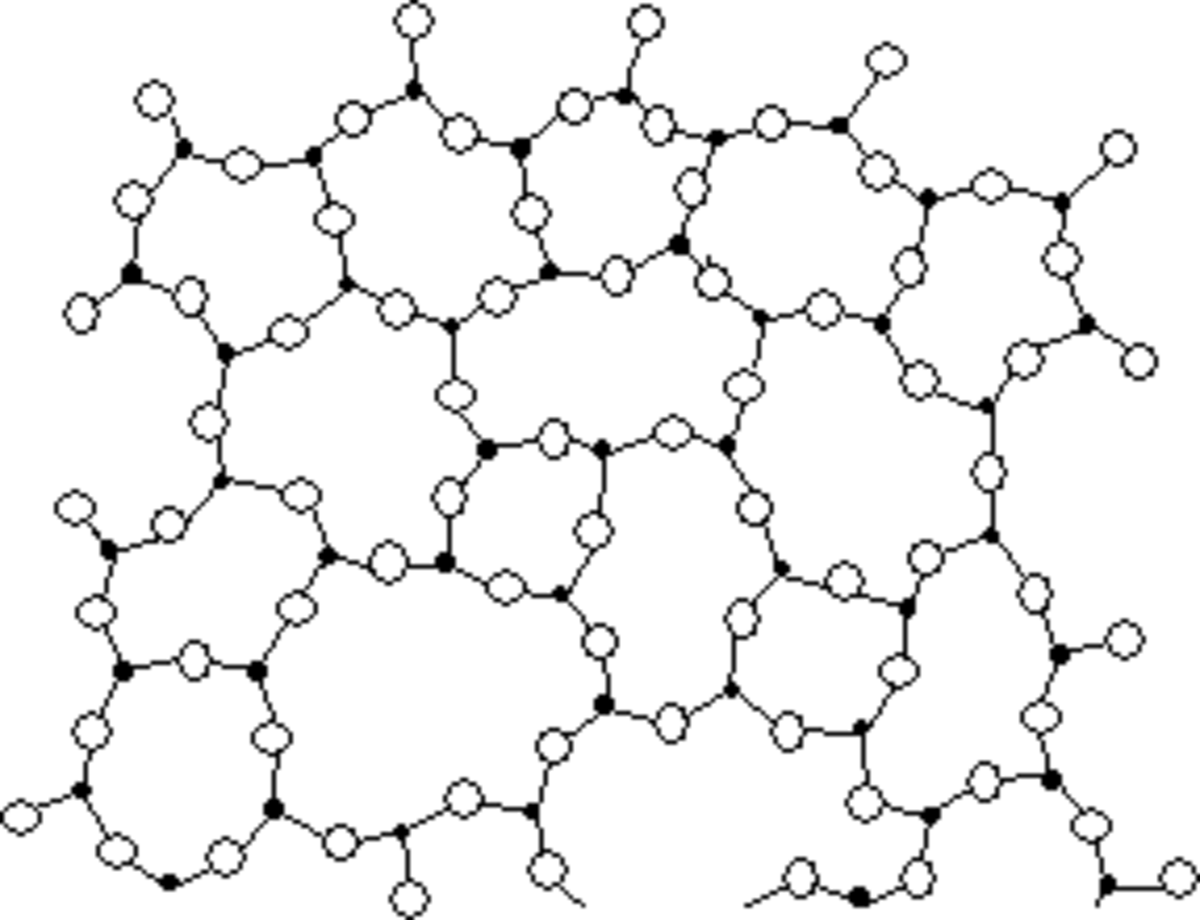
Le verre est un matériau amorphe, c’est-à-dire non cristallin. De ce fait, il présente un désordre structural important. Sa structure microscopique est telle qu’il n’existe aucun ordre à grande distance dans un verre. Un verre peut même être vu comme un « réseau » tridimensionnel, semblable à celui d’un cristal, mais dans lequel seul l’ordre à courte distance est conservé.
Comparons, par exemple, la structure de la silice (SiOv(2)) cristalline (sous sa forme cristobalite) et celle de la silice vitreuse.
Dans les deux cas, chaque atome de silicium est lié avec quatre atomes d’oxygène, formant ainsi des tétraèdres SiO4 ; chaque tétraèdre pouvant être considéré comme une « brique » de l’édifice final. Mais tandis que la cristobalite peut être définie comme un empilement régulier de ces briques SiO4, la silice vitreuse peut être considérée comme un empilement anarchique de ces mêmes briques SiO4.
En raison de sa structure amorphe, les verres produisent, en diffraction des Rayons X (DRX), un halo de diffusion, contrairement aux cristaux qui donnent des pics étroits et intenses.
Principaux composants
En raison de sa structure amorphe, le verre est soumis à très peu de contraintes stoechiométriques. De ce fait, un verre peut inclure en son sein une très grande variété d’éléments et présenter des compositions très complexes.
Dans un verre d’oxydes, ces différents éléments sont sous une forme cationique, afin de former des oxydes avec l’anion oxygène O2-.
Les cations intervenant dans la composition de verres peuvent être classés en trois catégories selon le rôle structural qu’ils jouent lors de la vitrification (formation du verre) : les formateurs de réseau, les non-formateurs de réseau (ou modificateurs de réseau) et les intermédiaires. Les critères structuraux de cette classification prennent en compte le nombre de coordination (nombre d’atomes d’oxygène auquel est lié le cation) et les forces de liaison.
Formateurs de réseau
Les formateurs de réseau sont des éléments qui peuvent à eux seuls former un verre. Les éléments formateurs les plus courants sont le silicium Si (sous sa forme oxyde SiO2), le bore B (sous sa forme oxyde B2O3), le phosphore P (sous sa forme oxyde P2O5), le germanium Ge (sous sa forme oxyde GeO2) et l’arsenic As (sous sa forme oxyde As2O3).
Ce sont des éléments métalliques de valence assez élevée (généralement 3 ou 4, parfois 5), qui forment des liaisons mi-covalentes mi-ioniques avec les atomes d’oxygène. Ils donnent des polyèdres de faible coordinence (3 ou 4), comme SiO4, BO4 ou BO3. Ces polyèdres sont liés par leurs sommets et forment le réseau vitreux.
Modificateurs de réseau
Les modificateurs de réseau (ou non-formateurs) ne peuvent pas former de verre à eux seuls. Ce sont essentiellement les alcalins, les alcalino-terreux et dans une moindre mesure certains éléments de transition et les terres rares.
Ils sont habituellement plus volumineux (rayon ionique plus important) que les formateurs de réseau, faiblement chargés et donnent des polyèdres de grande coordinence. Leurs liaisons avec les atomes d’oxygène sont plus ioniques que celles établies par les formateurs.
Ils peuvent avoir deux rôles structuraux bien distincts, soit modificateurs de réseau vrais, soit compensateurs de charge.
- Les modificateurs de réseau vrais cassent les liaisons entre les polyèdres du réseau vitreux provoquant une dépolymérisation de ce dernier. Ils transforment alors les oxygènes pontants, qui lient deux éléments formateurs de réseau, en oxygènes non-pontants, liés à un seul formateur de réseau. Ceci se traduit à l’échelle macroscopique par une diminution du point de fusion et de la viscosité.
- Les compensateurs de charge quant à eux compensent une charge négative sur un polyèdre formateur de réseau, par exemple BO4-, lui permettant d’être stable dans cette configuration.
Intermédiaires
Les éléments intermédiaires ont différents comportements : certains de ces éléments sont soit formateurs, soit modificateurs selon la composition du verre tandis que d’autres n’auront ni l’une ni l’autre de ces fonctions mais un rôle intermédiaire.
Les principaux éléments intermédiaires dans les verres d’oxydes sont l’aluminium Al, le fer Fe, le titane Ti, le nickel Ni et le zinc Zn.
Centres colorés

Des métaux et des oxydes métalliques peuvent être ajoutés lors du processus de fabrication du verre pour influer sur sa couleur. L’ajout d’une faible quantité de manganèse permet d’élimer la teinte verte produite par le fer. À des concentrations plus élevées, il permet l’obtention d’une couleur proche de celle de l’améthyste. De même que le manganèse, le sélénium utilisé en faible quantité permet de décolorer le verre. Une quantité plus importante produit une teinte rouge. Le verre est teint en bleu par l’ajout d’une faible concentration de cobalt (0,025 à 0,1 %). L’oxyde d’étain et les oxydes d’antimoine et d’arsenic permettent de produire un verre blanc opaque. Ce procédé a été utilisé pour la première fois à Venise pour obtenir une imitation de porcelaine. L’ajout de 2 à 3 % d’oxyde de cuivre produit une couleur turquoise. L’ajout de cuivre métallique pur conduit à un verre rouge très sombre, opaque, parfois utilisé comme substitut au rubis doré. Suivant la concentration utilisée, le nickel permet de produire des verres bleus, violets ou même noirs. L’ajout de titane conduit à un verre jaune-brun. L’or métallique ajouté à des concentrations très faibles (voisines de 0,001 %) permet d’obtenir un verre de couleur rubis, tandis que des concentrations plus faibles encore conduisent à un verre de rouge moins intense, souvent présenté comme « groseille ». De l’uranium (0,1 à 2 %) peut être ajouté pour donner au verre une teinte jaune ou verte fluorescente. Le verre à l’uranium n’est pas assez radioactif pour être dangereux. En revanche, s’il est broyé pour former une poudre, par exemple en le polissant avec du papier de verre, la poudre peut être cancérigène par inhalation. Les composés à base d’argent (notamment le nitrate d’argent) permettent d’obtenir des teintes dans une gamme allant du rouge orangé au jaune. La couleur obtenue par l’ajout de ces différents additifs dépend de manière significative de la façon dont le verre a été chauffé et refroidi au cours du processus de fabrication.
Transition vitreuse
D’un point de vue thermodynamique, le verre est obtenu à partir d’une phase liquide surfondue solidifiée au point de transition vitreuse, Tg.
Pour une composition donnée, on s’intéresse à la variation d’une grandeur thermodynamique comme le volume occupé par cette phase (en maintenant la pression constante) ou une des fonctions thermodynamiques énergétiques molaires, comme l’enthalpie H, par exemple (on aurait aussi pu choisir l’énergie interne U).
Intéressons-nous au refroidissement d’un liquide. A priori, pour des températures inférieures à la température de fusion Tf (Tf dépend de la pression), l’état le plus stable thermodynamiquement correspond à l’état cristallisé (enthalpie la plus faible possible). À Tf, on observe alors une variation de H ainsi qu’un changement de pente de H (cette pente est beaucoup plus faible pour un solide que pour un liquide).
Mais si, lors du refroidissement du liquide, la viscosité est trop importante ou le refroidissement très rapide, la cristallisation n’a pas le temps de se produire et un liquide surfondu est alors obtenu. Aucune discontinuité de H n’est alors observée à Tf et sa pente reste inchangée. En poursuivant le refroidissement, la viscosité du liquide augmente de façon exponentielle et le liquide surfondu devient quasiment solide. Lorsqu’elle atteint 1013 poises, la rigidité empêche les mouvements microscopiques locaux et on observe un changement de pente de l’enthalpie (la pente devient la même que pour celle du composé cristallisé). La température à laquelle se produit ce changement s’appelle température de transition vitreuse, Tg. Pour une température inférieure à Tg, le matériau est un solide avec le désordre structural d’un liquide : c’est un verre. Le désordre, et donc l’entropie, sont plus élevés dans un verre que dans un cristal.
Le passage continu de l’état liquide à l’état vitreux se fait dans une plage de température délimitée par la température de fusion (Tf) et la température de transition vitreuse (Tg). La zone de transition vitreuse encadre Tg. En dessous de Tg, le verre devient "hors équilibre": il s'éloigne de son équilibre thermodynamique, on dit que le verre est l'isostructural d'un liquide de température plus élevée (ce qu'on appelle la température fictive). Le temps de relaxation nécessaire pour atteindre l’équilibre de configuration (l'équilibre thermodynamique) est alors supérieur au temps d’expérience. Ainsi, le verre est un matériau métastable, évoluant inévitablement vers l’état d'équilibre mais pouvant persister à l’état vitreux sur des périodes de temps très longues. C’est le cas par exemple de l’obsidienne, verre volcanique naturel, dont on peut trouver des spécimens vieux de plusieurs millions d’années.
Malgré sa forte viscosité, le verre conserve certaines propriétés des liquides dont notamment le caractère désordonné, mais contrairement aux liquides usuels son temps de relaxation est considérable et le verre ne peut pas « couler » aux échelles de temps humaines. Ainsi d’après Daniel Bonn, du Laboratoire de physique statistique de l’ENS, si les vitraux des cathédrales, ou les glaces de la Galerie des Glaces au château de Versailles sont plus épaisses à la base qu’à leur sommet, c’est du fait du procédé de fabrication utilisé, la partie la plus épaisse étant disposée vers le bas pour des raisons de stabilité. Si la description du verre comme un liquide extraordinairement visqueux n’est pas complètement infondée, elle reste donc très discutable.
Résistance chimique et Altération du verre
Le verre industriel a de bonnes compatibilités avec la plupart des composés chimiques, par contre l’acide fluorhydrique (HF) dégrade facilement le verre.
Les verres ne sont pas insensibles à l’action de l’eau ou de l’air. Bien sûr, cela n’empêche pas l’existence de verres ayant plusieurs millions d’années et non altérés car la sensibilité des verres à l’altération dépend de leur composition chimique.
Contrairement à une idée reçue assez courante, le verre solide ne s’écoule pas ni à l’échelle des temps historiques, ni à l’échelle des temps géologiques.
Calcul de propriétés
Valeurs représentatives
Les valeurs qui suivent ne sont destinées qu’à fournir un ordre de grandeur, car il existe plusieurs variétés de verres, des flints lourds (chargés en plomb ; masse volumique variant de 2 500 à 5 900 kg/m3) au verre à vitre standard (2 500 kg/m3) en passant par les crowns (de 2 200 à 3 800 kg/m3), etc.
| Propriété physique | Valeur | Unité |
|---|---|---|
| Masse volumique | 2 500 | kg/m3 |
| Module de Young | 69 000 | MPa |
| Coefficient de Poisson | 0,25 | - |
| Limite d'élasticité | 3 600 | MPa |
| Résilience | de 1 500 à 2 500 | Pa |
| Coefficient de dilatation linéaire | de 0,5 à 15×10-6 | /°C |
| Conductibilité thermique | 1 | W/m/°C |
Calcul par combinaison des propriétés de différentes phases
Les propriétés de verre peuvent être calculées par l’analyse statistique des bases de données de verre, par exemple SciGlass et Interglad. Si la propriété de verre désirée n’est pas liée à la cristallisation (par exemple, la température de liquidus) ou à la séparation de phase, la régression linéaire peut être appliquée en utilisant des fonctions polynômes communes jusqu’au troisième degré. Au-dessous figure une équation d’exemple du deuxième degré. Les C-valeurs sont les concentrations composantes de verre comme Na2O ou CaO en pourcentage ou d’autres fractions, les b-valeurs sont des coefficients, et n est le chiffre total des composants de verre. La composante principale de verre, la silice (SiO2), est exclue dans l’équation ci-dessous en raison de l’au-dessus-paramétrisation, due à la contrainte que tous les composants résument à 100 %. Beaucoup de termes dans l’équation ci-dessous peuvent être négligés au moyen de l’analyse de corrélation et de signification.
Propriété du verre =
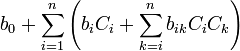
Autres verres
Par extrapolation le nom de verre est employé pour d’autres matériaux amorphes.
Par exemple, des mélanges à base de fluorures de zirconium, baryum, lanthane et aluminium produisent des verres fluorés plus transparents dans l’ultraviolet et le proche infrarouge que le verre de silice. Ils servent donc à fabriquer des instrument optiques pour ces rayonnements.
Beaucoup de verres de lunettes sont fabriqués avec des verres organiques qui sont des polymères à base de carbone comme le polycarbonate de bisphénol A ou le polycarbonate d’allyle.
Certains alliages métalliques peuvent être solidifiés avec une structure amorphe grâce à un refroidissement très rapide, on les appelle alors des verres métalliques. On peut par exemple projeter le métal en fusion sur un tambour de cuivre tournant à grande vitesse. Ces alliages sont utilisés par exemple pour les cœurs de transformateurs. En effet leur cycle d’hystérésis est très faible, ce qui réduit considérablement les pertes.
On peut obtenir des dépôts d’alliages métalliques (Al-Cu-Fe) amorphe par dépôt sous vide.
Certains aciers peuvent être solidifiés sous forme amorphe. Du fait de leur isotropie, ils ont des propriétés non-magnétiques intéressantes notamment pour la construction de sous-marins furtifs. Ils ont également une grande dureté et une très bonne tenue à la corrosion.
Verre biologique
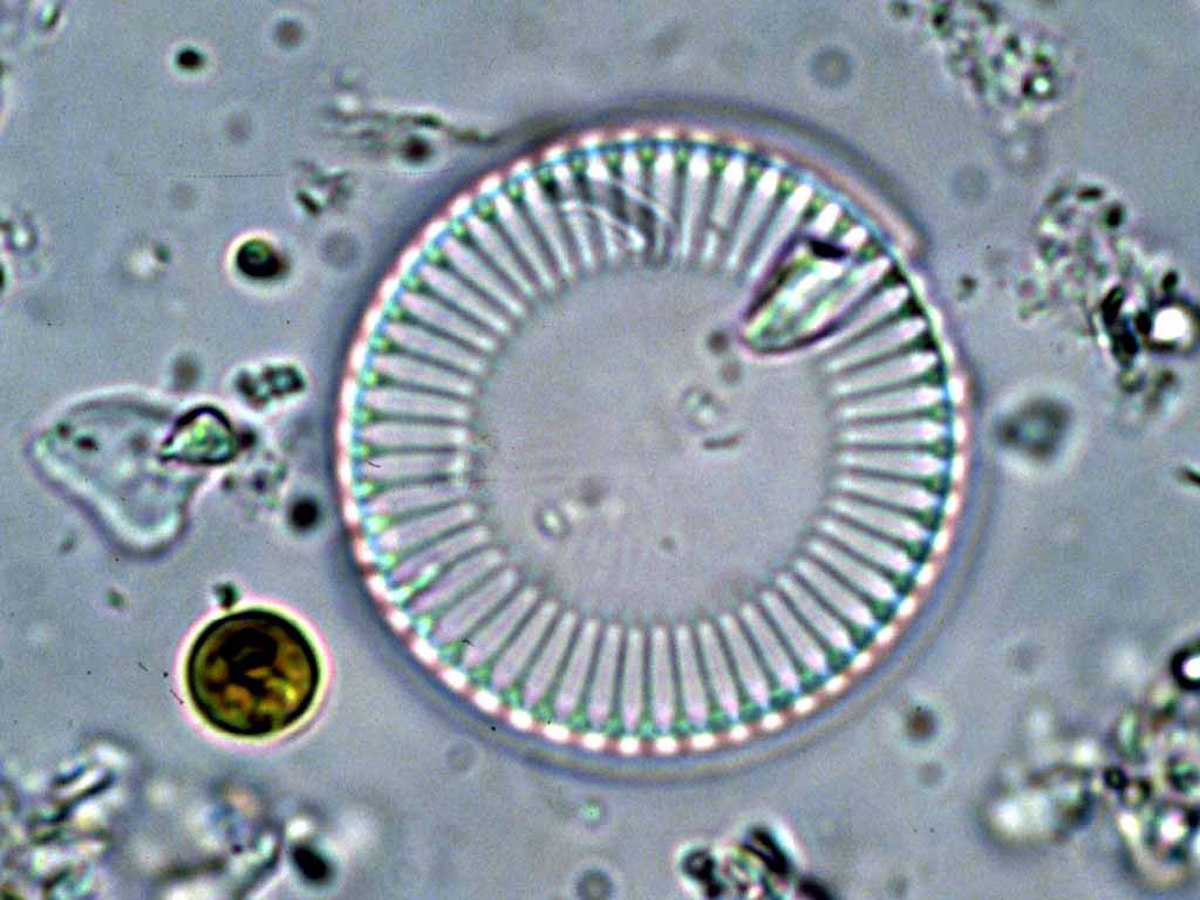
L’espèce vivante la plus grosse productrice de verre n’est pas l’homme, mais la famille des diatomées. En effet, ces algues unicellulaires sont protégées par une coque de verre aux formes surprenantes et délicates. Constituant du plancton, la masse de ce verre est considérable et bien supérieure à la production humaine. Depuis 2008, les scientifiques commencent à identifier le détail de la synthèse : elle part des silicates présents dans l’eau de mer, et ils commencent à savoir reproduire en laboratoire des réactions similaires. Cette fabrication a lieu dans des conditions physiques de la chimie douce, c’est-à-dire qu’elle ne nécessite ni température ni pression élevées.
L’intérêt majeur du verre pour la diatomée est de ne pas faire obstacle à la photosynthèse en laissant passer la lumière. Il est synthétisé très rapidement au moment de la méiose.