Vaccination contre la grippe A (H1N1) de 2009-2010 - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La vaccination contre la grippe A (H1N1) de 2009-2010 est inédite à l'échelle internationale à la fois par la rapidité avec laquelle les vaccins ont été développés, par les campagnes de vaccinations organisées, ainsi que par l'ampleur des polémiques déclenchées. De plus, s'appuyant sur les structures mises en place suite à l'épisode de grippe aviaire A(H5N1), cette campagne est exceptionnelle par la coordination internationale qui s'est instaurée autour de cette pandémie, notamment sur les dispositifs de pharmacovigilance instaurés pour le suivi des effets indésirables des vaccins.
Les vaccins contre la grippe A (H1N1) de 2009-2010 ont été développés dans les mois qui ont suivi l'émergence du virus à partir de la souche principale dite « A/California/07/2009/(H1N1) », isolée en avril 2009 au Mexique et en Californie.
Ces vaccins ont été rapidement mis sur le marché à large échelle auprès de nombreux pays dans le cadre de campagnes de vaccination massives destinées à enrayer la propagation de l'épidémie avant la saison hivernale. Ces campagnes ont eu un succès variable suivant les pays. Des polémiques ont surgi, portant à la fois sur les risques médicaux potentiels associés à une opération de cette envergure avec des produits développés rapidement mais aussi sur les aspects sociaux et politiques de ces campagnes (la logistique employée, les coûts induits par l'achat des vaccins et par l'organisation de la vaccination, la communication gouvernementale, etc.).
Les vaccins
Les vaccins produits contre le virus H1N1 diffèrent sur plusieurs points :
- Antigène : virion inactivé fragmenté, virion inactivé entier ou antigène de surface seulement
- Mode de culture : sur œuf, sur cellules MDCK
- Présence ou non d'adjuvants
- Concentration
- Mode d'administration : par injection ou administration intra-nasale
- Conditionnement : dose unique ou multi-doses
Par conséquent, les différents vaccins commerciaux n'ont pas reçu les mêmes autorisations de mise sur le marché, de plus, les procédures différent d'un pays à l'autre.
Composition des vaccins
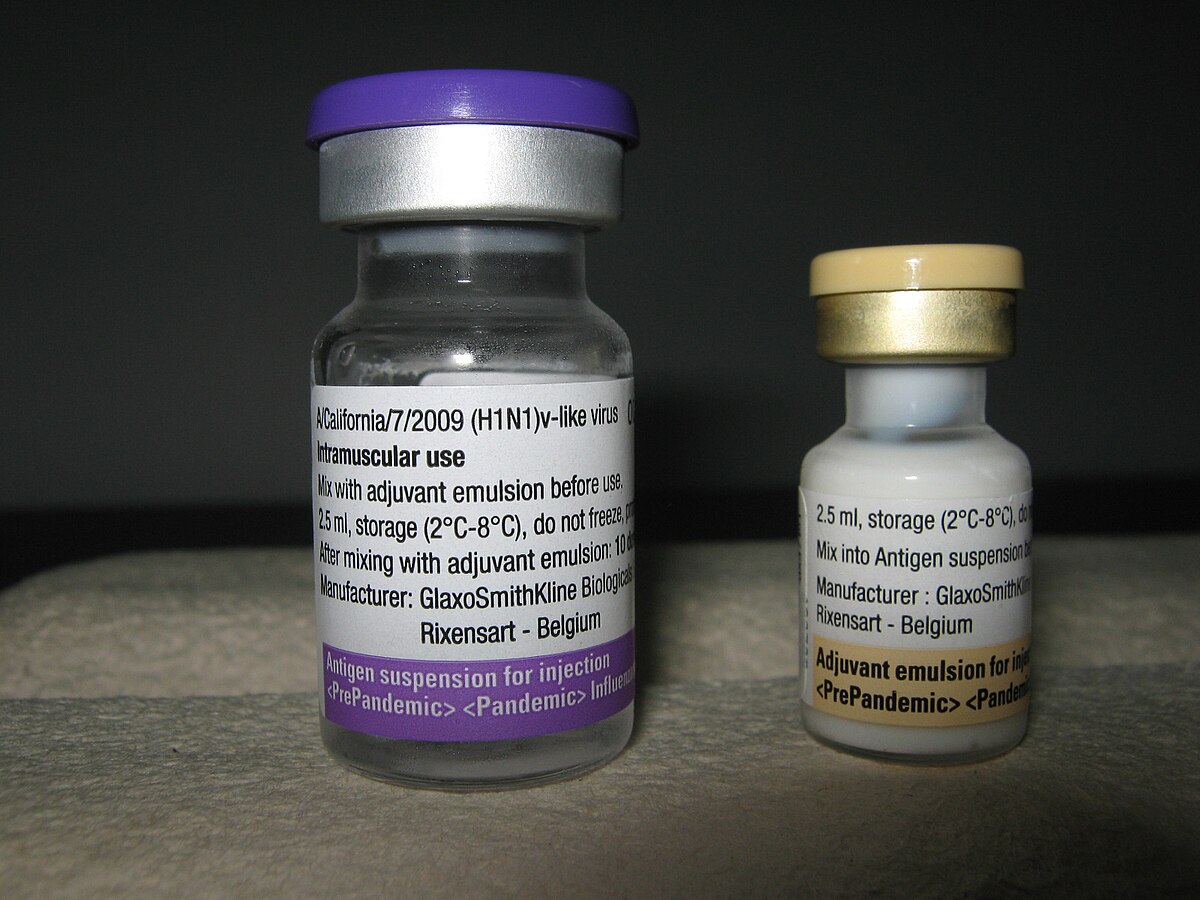
Une des différences importantes entre les divers vaccins réside dans la présence ou non d'adjuvants permettant d'améliorer la réponse immunitaire et donc de produire plus de vaccins avec moins de substances antigéniques.
Le principal agent adjuvant utilisé dans les vaccins contre les virus influenza est le squalène. Le squalène est un lipide présent naturellement dans le foie de nombreuses espèces animales, dont les humains, et qui, lorsqu'il est émulsionné, augmente la réaction immunitaire par production d'une réaction inflammatoire, stimulant ainsi la production d'anticorps. Dans la production industrielle, il est généralement extrait de l'huile de foie de requin.
Fabrication des vaccins
Sanofi-Pasteur, GlaxoSmithKline (GSK) et Novartis utilisent des œufs embryonnés de poules pour cultiver le virus tandis que Baxter utilise des cellules de rein de singe vert africain pour la culture du virus.
Deux types de vaccins ont été préparés dans les laboratoires. L'un, créé de toutes pièces, mettra des mois avant de franchir toutes les étapes nécessaires à sa validation. Le second, dit vaccin mock-up ou vaccin-maquette, avait été préparé en réponse à l'épidémie de grippe aviaire H5N1. Tous les vaccins maquette ont été préparés initialement avec une souche H5N1 du virus de la grippe qui sera changée à partir du 20 août 2009 pour la souche H1N1 qui est à l'origine de la pandémie. La Commission européenne a autorisé la commercialisation des vaccins :
- Celvapan, de Baxter AG ;
- Daronrix, de GlaxoSmithKline Biologicals S.A. ;
- Focetria, de Novartis Vaccines and Diagnostics S.r.l. ;
- Pandemrix, de GlaxoSmithKline Biologicals S.A. ;
- Humenza, de Sanofi Pasteur MSD, type fragmenté, 3,75 µg d'antigène, adjuvant AS03 ;
- Panenza, de Sanofi Pasteur MSD, fragmenté, 15 µg, sans adjuvant.
Essais cliniques
Les premières évaluations du vaccin ont été publiées le 10 septembre 2009 dans la revue médicale américaine The New England Journal of Medicine. Une première étude portant sur le vaccin non-adjuvanté a conclu à une bonne efficacité contre la souche virale : la protection (mesurée par le titrage des anticorps et le taux de séroconversion) est plutôt élevée, même avec une seule injection et les effets secondaires sont assez limités. La seconde étude présente les résultats portant sur le vaccin avec adjuvant (MF59) mais utilisant une dose deux fois inférieure à la version non-adjuvantée : elle conclut à une efficacité similaire sans augmentation notable des effets secondaires.
Les effets primaires (sur l'augmentation de la réponse immunitaire) et indésirables (notamment des adjuvants au squalène) ont fait l'objet de multiples études cliniques sur plusieurs dizaines de milliers de personnes pour des vaccins anti-grippaux ou non. La plupart de ces études concluent à une bonne efficacité des vaccins adjuvantés (voire meilleure par rapport aux vaccins non-adjuvantés) et à l'absence d'effets indésirables notables. Ces résultats semblent confirmés par l'analyse rétrospective du suivi de pharmacovigilance des vaccins adjuvantés, qui ont été utilisés chez plus de 27 millions d'individus sur la dernière décennie.
Selon une étude publiée en octobre 2009, le vaccin contre la grippe saisonnière (qui comprend traditionnellement une souche A H1N1, la souche Brisbane/59 pour la campagne 2009/2010) pourrait avoir une efficacité préventive partielle contre la souche de grippe A H1N1 pandémique de 2009 (souche A/California/07/2009).
Les vaccins commerciaux
Les principaux vaccins commercialisés sur le marché occidental sont :
- Vaccins par injection :
- Adjuvantés à virion inactivé fragmenté :
- Novartis (Suisse) produit le Focetria (adjuvant MF59)
- GlaxoSmithKline (Royaume-Uni) produit le Q-Pan H1N1 (adjuvant AS03)
- Sanofi Aventis (France) produit le Humenza (adjuvant AF03)
- Adjuvantés à antigènes de surface :
- GlaxoSmithKline (Royaume-Uni) produit le Pandemrix (adjuvant AS03)
- Novartis produit le Celtura (adjuvant MF59)
- Non-adjuvanté à virion inactivé fragmenté :
- Sanofi Aventis (France) produit le Panenza
- Non-Adjuvanté à virion inactivé entier :
- Baxter International (États-Unis) produit le Celvapan
- Adjuvantés à virion inactivé fragmenté :
- Vaccins par spray nasal :
- AstraZeneca (États-Unis) produit le MedImmune
Autres :
- Hualan Biological Engineering (Chine)
- Sinovac (Chine)
- CSL (États-Unis) : Panvax®H1N1
- Omnivest (Hongrie)
Le 7 août 2009, le laboratoire Baxter a annoncé disposer d'un vaccin (le Celvapan) et être en discussion avec les autorités sanitaires pour sa distribution C'est un vaccin dit « mock-up » ou « vaccin-maquette », une version adaptée du vaccin pré-pandémique initialement mis au point contre le virus aviaire A(H5N1). Ce prototype disposait déjà d’une autorisation de mise sur le marché (AMM) accordée par l’Agence européenne des médicaments (EMEA). Ce procédé permet une autorisation accélérée du vaccin pandémique, sans déposer une nouvelle demande d’AMM.
Autorisations de mises sur le marché
Les différents vaccins ont reçu des agréments variables suivant les autorités de chaque territoire.
En novembre 2009, l'Agence européenne du médicament a autorisé les vaccins Focetria et Pandemrix.
L'Agence française de sécurité sanitaire des produits de santé a autorisé Focetria et Pandemrix ainsi que le vaccin non-adjuvanté de Sanofi, Panenza.
La Food and Drug Administration américaine a autorisé les vaccins MedImmune et un vaccin non-adjuvanté de GlaxoSmithKline.