Trichlorure de rhodium - Définition
La liste des auteurs de cet article est disponible ici.
Préparation
RhCl3(H2O)3 est produit sous l'action de l'acide chlorhydrique sur l'oxyde de rhodium(III) hydraté. RhCl3(H2O)3 peut être recristallisé à partir d'une solution concentrée d'acide chlorhydrique. Cette méthode permet d'éliminer les impuretés contenant de l'azote.
RhCl3 est produit par la réaction du dichlore avec une éponge de rhodium à une température comprise entre 200 °C et 300 °C. La réaction équivalente dans un bain de chlorure de sodium fondu conduit à la formation de Na3RhCl6.
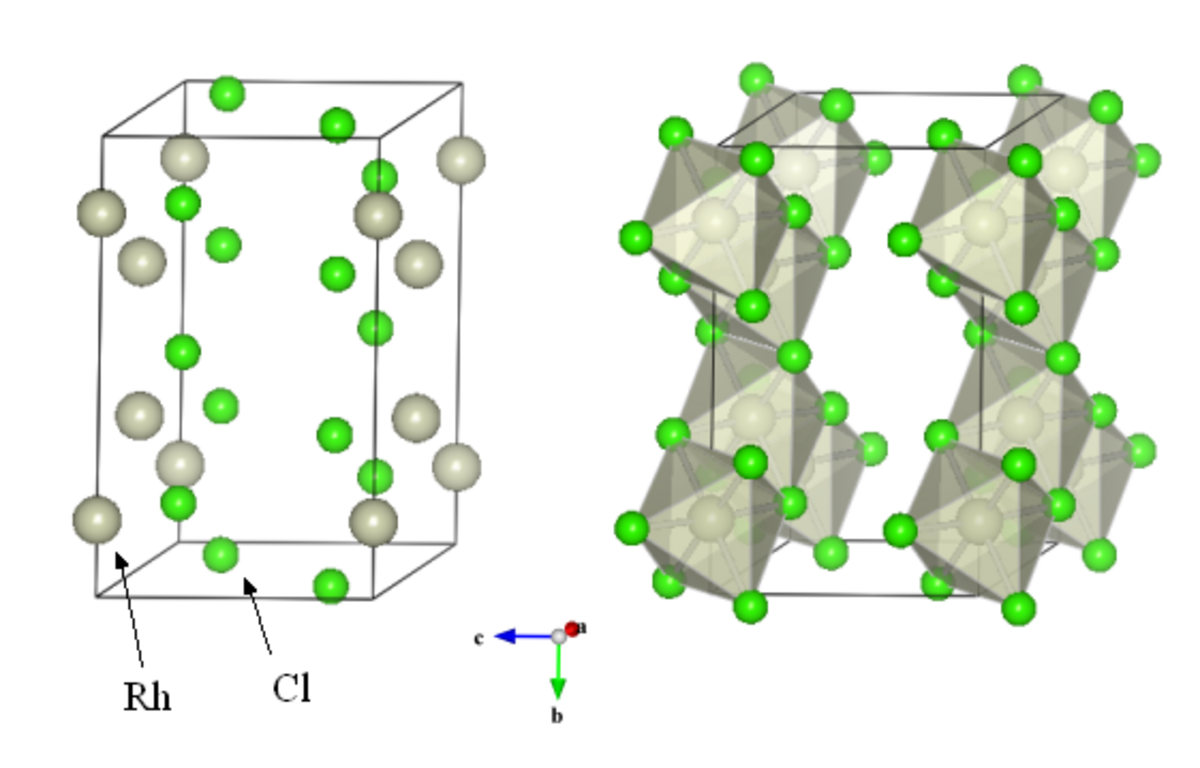
Structure cristalline
Le trichlorure de rhodium cristallise dans une structure monoclinique (structure type AlCl3), avec un groupe d'espace C 2/m. La maille monoclinique possède les caractéristiques suivantes :
a = 5,95 Å
b = 10,3 Å
c = 6,03 Å
β = 109,2 °
Au sein de la maille, les atomes de rhodium occupent les positions 4g (y=0.167), les atomes de chlore occupent quant à eux deux positions, les positions 4i (x=0.226, z=0.219) et 8j (x=0.25, y=0.325, z=0.219). Les atomes de rhodium se situent donc au centre d'octaèdres d'atomes de chlore. Ces octaèdres liés par les arrêtes et les sommets forment une structure en couches.
Rhodium et catalyse
Au cours des années 1960, il a été montré que RhCl3(H2O)3 peut jouer le rôle de catalyseur pour une grande variété de réactions mettant en jeu CO, H2, et les alcènes. Par exemple, RhCl3(H2O)3 permet la dimérisation de l'éthylène pour former un mélange de cis- et trans- but-2-ène :
-
- 2 C2H4 → CH3-CH=CH-CH3
Cette réaction ne se produit pas avec des alcènes comportant plus de carbone.
Au cours des décennies suivantes, cependant, les catalyseurs à base de rhodium ont permis le développement de réactions dans des solvants organiques en utilisant des ligands organiques en lieu et place de l'eau. Ces découvertes, parmi d'autres, ont permis l'émergence de la catalyse homogène.
Bibliographie
- (en) Greenwood, N. N.; & Earnshaw, A., Chemistry of the Elements, Butterworth-Heinemann, Oxford, 1997
- (en) Canterford, J. H.; & Colton, R., Halides of the Second and Third Row Transition Metals, Wiley-Interscience, London, 1968
- (en) Cotton, S. A., Chemistry of the Precious Metals, Chapman&Hall, 1997