Thiophène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Thiophène | |||
|---|---|---|---|
 | |||
| Général | |||
| Nom IUPAC | |||
| Synonymes | Sulfure de divinylène Thiacyclopentadiène | ||
| No CAS | |||
| No EINECS | |||
| Apparence | liquide incolore, d'odeur âcre. | ||
| Propriétés chimiques | |||
| Formule brute | C4H4S | ||
| Masse molaire | 84,14 ± 0,008 g·mol-1 | ||
| pKa | 38,4 | ||
| Moment dipolaire | 0,55 ± 0,01 D | ||
| Propriétés physiques | |||
| T° fusion | -38 °C | ||
| T° ébullition | 84 °C | ||
| Solubilité | dans l'eau : nulle | ||
| Masse volumique | 1,06 g·cm-3, 2,9 (air=1) | ||
| T° d’auto-inflammation | 395 °C | ||
| Point d’éclair | -1 °C | ||
| Limites d’explosivité dans l’air | 1,5–12,5 %vol | ||
| Pression de vapeur saturante | à 12,5 °C : 5,3 kPa | ||
| Thermochimie | |||
| S0 | 181 J/mol·K | ||
| ΔH0 | 115,0 kJ/mol | ||
| ΔH0 | 81 kJ/mol | ||
| Cp | 122.4 J/mol·K (liq.) | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 8,86 ± 0,02 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,529 (20 °C) | ||
| Précautions | |||
| | |||
| |||
| | |||
|
3 1 0 | |||
| Écotoxicologie | |||
| LogP | 1,81 | ||
| | |||
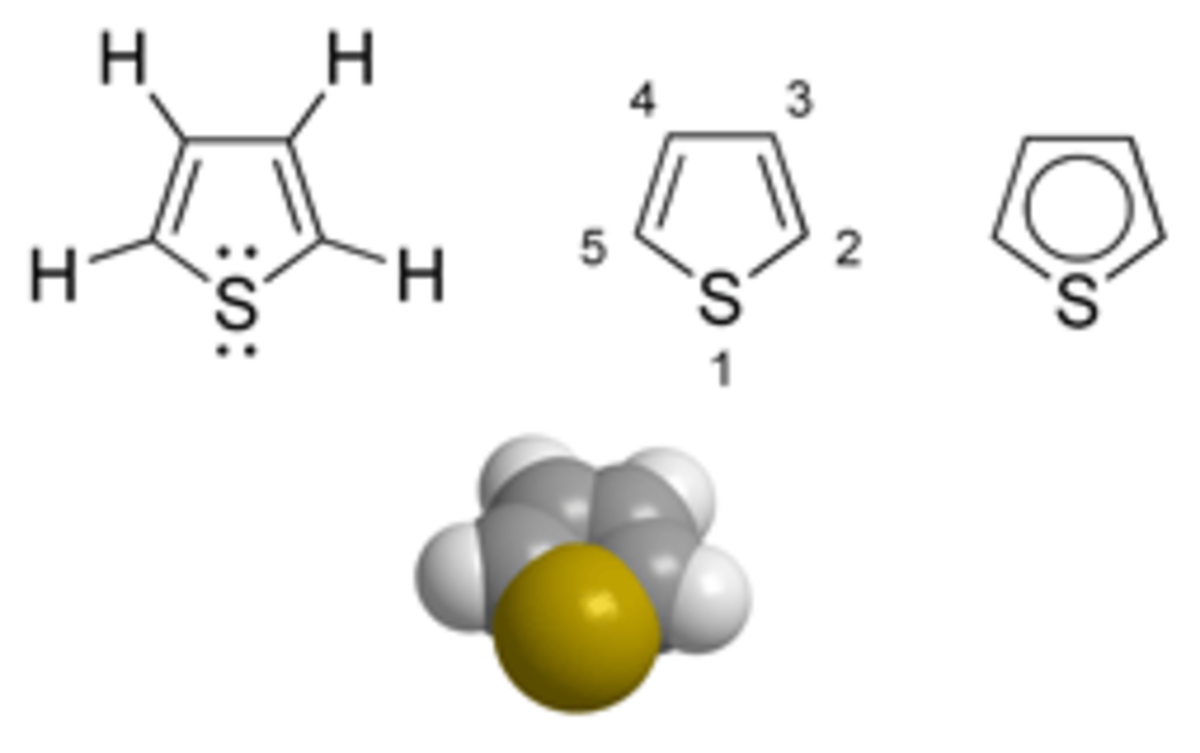
Le thiophène est un composé organique hétérocyclique aromatique. C'est un liquide limpide incolore ayant une odeur qui rappelle celle du benzène. Le thiophène est souvent trouvé naturellement dans le pétrole à des concentrations de quelques pourcents.
Le thiophène est un des composés utilisés pour dénaturer l'alcool.
La réaction de polymérisation du thiophène conduit au polythiophène.
Chimie
La chimie du thiophène est essentiellement marquée par son caractère aromatique (4 électrons apportés par les doubles liaisons, deux par le soufre). Le cycle peut donc subir les substitutions électrophiles aromatiques classiquement rencontrées sur les aromatiques, telles les halogénations, les réactions de type Friedel et Crafts (rarement en présence de chlorure d'aluminium, qui a tendance à favoriser des polymérisations par ouverture du cycle, néanmoins), des formylation de Wilsmeier-Haack, ...
De par la présence du soufre, les substitutions sont fortement orientées sur les carbones 2 et 5, et il est quasiment impossible d'orienter une réaction en position 3 ou 4 si ces deux positions ne sont pas déjà occupées. Une exception notable est par exemple l'isomérisation du 2-bromothiophène en 3-bromothiophène en présence de silice acide.
Le thiophène est cependant nettement plus fragile qu'un aromatique simple, et peut subir des réactions de dégradation en présence d'acide fort (notamment l'acide sulfurique) ou d'acide de Lewis (AlCl3).
L'hydrogénation des doubles liaisons est nettement plus simple que sur le benzène, mais il est très difficile de s'arrêter à une seule réaction.
