Thérapie génique - Définition
La liste des auteurs de cet article est disponible ici.
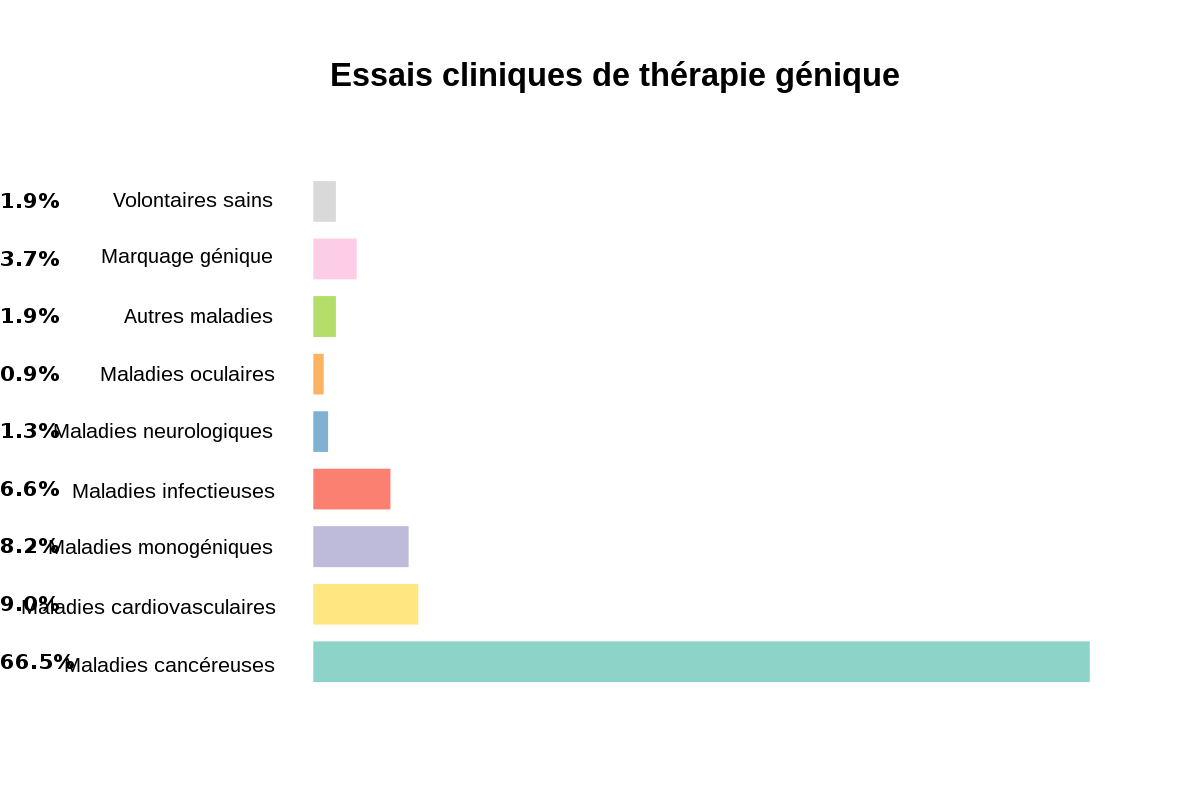
Beaucoup de pathologies sont des cibles potentielles de la thérapie génique
Alors que ce concept est né sur l'idée de traiter des pathologies héréditaires, il s'est rapidement orienté vers le traitement de toutes les affections, héréditaires ou non, dans lesquelles il était possible d'imaginer que certains gènes étaient défectueux ou qu'il était possible d'envisager un rôle pour de nouveaux gènes. Les cancers, les infections virales, la douleur, les affections cardiaques, les atteintes traumatiques du système nerveux… Conceptuellement, il n'est pas une pathologie qui ne pourrait pas bénéficier d'une approche de thérapie génique, que ce soit par une stratégie de restauration d'une activité génétique défaillante ou par la production d'une activité supplémentaire qui puisse avoir un impact thérapeutique. Pratiquement, depuis le premier essai clinique (qui s'intéressait alors au traitement du cancer), on observe qu'environ 70% des essais se sont focalisés sur le traitement du cancer, environ 20% sur le traitement de maladies héréditaires classiques, et 10% sur des affections diverses comme les infections virales. Environ 1400 essais cliniques auraient été proposés au niveau international. Si le jeu des statistiques est tentant, il faut toutefois se garder de tirer des conclusions claires de l'analyse globale de ces protocoles qui s'intéressent à des pathologies, des technologies et des concepts très diversifiés.
Une réussite mitigée, de nombreux échecs, les premiers effets secondaires
La plupart, sinon la totalité des essais cliniques de thérapie génique depuis le début des années 1990 peuvent être considérés comme des échecs dans la mesure où ils n'ont que très rarement, et que brièvement, amélioré l'état clinique des patients, et ils n'ont jamais abouti à la mise en place de thérapeutiques reconnues et utilisées au niveau international. Actuellement une seule stratégie, celle employée par Alain Fischer et Marina Cavazzana-Calvo, visant à traiter l'incapacité à développer des réponses immunitaires de nouveau-nés atteints d'immunodéficience sévère (SCID, Severe Combined Immunodeficiency) peut être considérée comme une réussite avec cependant une situation complexe car cette stratégie est parfois à l'origine d'effets secondaires graves. En 1998-99, de très jeunes enfants atteints du SCID-X souffrant d’une immunodéficience (des "bébé bulles") ont reçu un traitement visant à rendre actif leurs lymphocytes T déficients. Plus précisément, la thérapie consistait à insérer un gène fonctionnel restaurant la fonctionnalité d'un récepteur de l’interleukine 2. La mutation de certaines protéines de ce récepteur empêche ces malades de disposer d’une réaction immunitaire efficace les rendant sensibles à toutes les infections opportunistes. Dans un premier temps, l’entreprise s’est révélée être une réussite totale avec la guérison des patients: la plupart des bébés ont pu sortir de leurs bulles et vivre normalement. Cependant, quatre de ces patients sur la vingtaine d'enfants traités par ce type de thérapie ont développé une leucémie après quelques années. De nombreuses données convergent pour penser que le type de vecteur utilisé pourrait s'intégrer dans des régions sensibles du génome, et en dérégulant certains gènes, comme le proto-oncogène LMO2 (un gène fréquemment retrouvé activé dans des lymphomes naturels) pourrait participer à ces formes de leucémies induites. On peut corréler cette intégration du vecteur à la multiplication anarchique des globules blancs encore indifférenciés à l’origine de la leucémie. Il s'agirait donc bien d'un effet secondaire direct imputable à la stratégie elle-même, même si le développement de ce type de leucémie n'a pas été décelé dans la majorité des patients impliqués dans les divers essais cliniques de ce type réalisés par le monde.
Cet essai clinique "phare" de la thérapie génique a eu plusieurs répercussions. Il a tout d'abord montré que le concept de thérapie génique était valable et qu'une stratégie de manipulation du génome pouvait avoir un impact thérapeutique. Mais il a mis aussi en évidence la nécessité d'améliorer les stratégies (utilisation de nouveaux vecteurs limitant les insertions génotoxiques, réduction de la quantité de cellules exposées au vecteur puis réinjectées au patient, afin de limiter le risque de toucher un autre gène…) et les risques qui pouvaient être associés à cette stratégie. Enfin, et de manière très inopportune, il a aussi fortement freiné le développement d'une thérapie génique qui commençait à souffrir d'une mauvaise réputation étant donné le peu de réussites observées dans les protocoles cliniques. Ces événements sont rentrés en synergie avec le décès d'un patient aux États-Unis en 1999, Jerry Jelsinger, lors de l'injection de fortes doses d'un vecteur dérivé d'un adénovirus, qui a ébranlé la communauté scientifique et médicale, et celui en 2007 d'un patient traité par un vecteur dérivé de AAV.
Les résultats de certains protocoles sont actuellement mis en avant avec notamment en 2007-2008 des essais cliniques sur des pathologies de la vision, ou des pathologies neuronales infantiles (LINCL ou late infantile neuronal ceroid lipofuscinosis) dans lesquels des signes positifs d'amélioration clinique sont rapportés. La prudence est de mise et ces résultats restent toutefois non seulement à confirmer, mais aussi à améliorer dans l'avenir, car l'annonce d'un résultat positif n'implique pas forcément que l'on soit proche des requis thérapeutiques pour que le traitement puisse prendre sa place dans un contexte hospitalier classique.