Tableau périodique des éléments - Définition
La liste des auteurs de cet article est disponible ici.
Périodicité des propriétés chimiques
Le grand intérêt de la classification périodique est d'organiser les éléments chimiques de telle sorte que leurs propriétés physicochimiques puissent être largement prédites par leur position dans la table. Ces propriétés évoluent différemment selon qu'on se déplace verticalement ou horizontalement dans le tableau.
Périodes et groupes du tableau périodique
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | He | |||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| 6 | Cs | Ba | * | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | * | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| ↓ | |||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | |||||
| * | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | |||||
| Tableau périodique des éléments chimiques | |||||||||||||||||||
- Une période désigne une ligne du tableau périodique. Elle se définit par le remplissage progressif des sous-couches électroniques jusqu'à atteindre la sous-couche s de la couche électronique suivante. Les propriétés des éléments varient généralement beaucoup le long d'une période, mais peuvent être localement assez similaires et constituer des séries chimiques complètes, notamment dans le bloc d (métaux dits « de transition ») et surtout dans le bloc f (lanthanides sur la 6ème période et actinides sur la 7ème période).
- Un groupe désigne une colonne du tableau périodique. Chacun des 18 groupes du tableau périodique standard (plus le 19ème groupe des éléments du bloc f, lanthanides et actinides) constitue souvent un ensemble d'éléments aux propriétés bien distinctes des groupes voisins, notamment aux extrémités gauche et droite du tableau périodique (c'est-à-dire dans les blocs s et p) où ils se sont vu attribuer des noms d'usage au cours du temps :
- Si les termes cristallogène, pnictogène et chalcogène sont aujourd'hui assez désuets, les quatre autres en revanche sont encore très employés car ils se confondent avec des séries chimiques de même nom.
Variations des propriétés le long d'une période
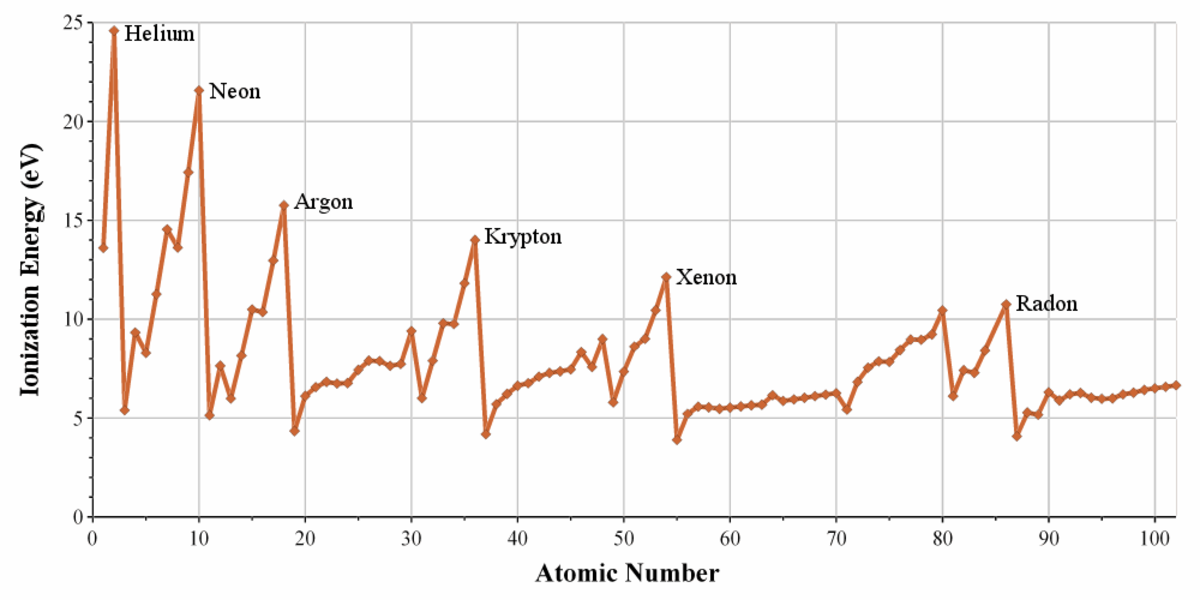
D'une manière générale, le rayon atomique tend à décroître lorsqu'on parcourt une période de gauche à droite. Ceci résulte du fait que la charge électrique du noyau atomique augmente tout au long de chaque période, ce qui augmente l'attraction du noyau sur les électrons et diminue par conséquent le volume des orbitales atomiques ; la contraction des lanthanides illustre très bien ce phénomène. En corollaire, l'énergie d'ionisation et l'électronégativité augmentent lorsqu'on parcourt une période de gauche à droite, puisque les électrons sont liés plus fortement au noyau à la droite du tableau.
L'affinité électronique tend également à croître légèrement, celle des métaux étant généralement inférieure à celle des non-métaux — hormis bien sûr celle des gaz rares.
Variation des propriétés dans un groupe
La description quantique de la configuration électronique des atomes permet d'expliquer la similitude des propriétés chimiques au sein d'un groupe par une configuration identique des électrons dans la couche de valence.
Le rayon atomique augmente rapidement de haut en bas d'un groupe, car à chaque période s'ajoute une couche électronique. En corollaire, l'énergie d'ionisation et l'électronégativité diminuent car les électrons périphériques sont moins fortement liés au noyau dans le bas du tableau.
Quelques exemples de groupes :
- Groupe 1 – métaux alcalins
- Hormis l'hydrogène, les éléments du premier groupe du tableau périodique constituent la série des métaux alcalins. Il s'agit de métaux peu denses de couleur argentée et à bas point de fusion, plutôt mous à température ambiante, formant des composés ioniques avec les halogènes et chimiquement très réactifs — ils réagissent violemment avec l'eau pour donner des hydroxydes qui sont des bases fortes — de sorte qu'on ne les trouve jamais sous forme élémentaire dans le milieu naturel.
- Groupe 2 – métaux alcalino-terreux
- Un peu plus durs et plus denses que les métaux alcalins, les métaux alcalino-terreux forment également des composés ioniques avec les halogènes mais ne réagissent pas avec l'eau à température ambiante, seulement avec la vapeur d'eau pour former des hydroxydes très basiques.
- Groupe 17 – halogènes
- Ils existent sous forme élémentaire diatomique et forment des acides forts avec l'hydrogène. Les halogènes constituent des composés ioniques avec les métaux alcalins et les métaux alcalino-terreux.
- Groupe 18 – gaz rares
- Aux conditions normales de température et de pression, ce sont des gaz monoatomiques incolores et inodores quasiment dépourvus de réactivité chimique, dont les points de fusion et d'ébullition sont séparés de moins de 10 °C à pression atmosphérique.
Relations diagonales
Outre les analyses par lignes et par colonnes, le tableau périodique permet également d'établir des relations diagonales entre certains éléments chimiques des deuxième et troisième périodes qui se trouvent en diagonale les uns par rapport aux autres dans le tableau. Il s'agit toujours de la direction diagonale allant du haut à gauche vers le bas à droite, car parcourir une période vers la droite et descendre le long d'une colonne se traduisent de façon opposée sur la couche de valence des atomes (respectivement : diminution et augmentation du rayon atomique, et en corollaire : augmentation et diminution de l'électronégativité ; cf. les deux paragraphes précédents). Il s'ensuit certaines similitudes entre éléments diagonaux, qui pourtant ne partagent ni la même période ni le même groupe.
Séries chimiques et autres regroupements
Au-delà des lignes, des colonnes et des diagonales, les éléments sont également regroupées en dix séries chimiques aux propriétés physicochimiques homogènes. Aux extrémités gauche et droite du tableau, ces séries se confondent avec les groupes, tandis qu'au centre du tableau elles ont plutôt tendance à ce confondre avec les blocs, voire avec les périodes :
- Série des métaux alcalins, égale au groupe 1, moins l'hydrogène.
- Série des métaux alcalino-terreux, confondue avec le groupe 2.
- Série des lanthanides, égale aux éléments du bloc f de la 6ème période, plus le lutécium 71Lu.
- Série des actinides, égale aux éléments du bloc f de la 7ème période, plus le lawrencium 103Lr.
- Série des métaux de transition, égale aux éléments du bloc d moins le lutécium 71Lu et le lawrencium 103Lr.
- Série des métaux pauvres, comprenant :
- sur la période 3 : l'aluminium 13Al ;
- sur la période 4 : le gallium 31Ga ;
- sur la période 5 : l'indium 49In et l'étain 50 ;
- sur la période 6 : le thallium 81Tl, le plomb 82Pb et le bismuth 83Bi ;
- sur la période 7 : par défaut, les éléments 113, 114, 115 et 116, qui demeurent néanmoins, en toute rigueur, chimiquement non classés.
- Série des métalloïdes :
- Série des non-métaux :
- Série des halogènes, confondue avec le groupe 17, moins l'élément 117.
- Série des gaz nobles, confondue avec le groupe 18, moins l'élément 118.
D'autres regroupements sont également en usage, par exemple :
-
- les terres rares, qui comprennent le scandium 21Sc, l'yttrium 39Y et les lanthanides ;
- le groupe du platine, qui regroupe les éléments des groupes 7 à 10 des périodes 5 et 6 excepté le technétium 43Tc.
Limites à la périodicité aux confins du tableau
La configuration électronique des éléments est décrite de façon satisfaisante par le modèle des orbitales atomiques jusqu'au milieu de la 7e période ; pour Z >> 100, des effets relativistes deviennent significatifs sur des électrons en interaction avec un noyau très fortement chargé, certaines corrections induites par l'électrodynamique quantique ne peuvent plus être négligées, les approximations considérant les électrons de façon individuelle pour déterminer les orbitales cessent d'être valides, et des effets de couplage spin-orbite redistribuent les niveaux d'énergie, et donc les sous-couches électroniques : il s'ensuit que la distribution des électrons autour du noyau obéit de moins en moins aux règles bien vérifiées pour les six premières périodes, et que les propriétés des éléments dans cette région du tableau cessent d'être prédictibles en fonction de leur groupe.
Ainsi, l'élément 118Uuo devrait être un gaz rare en vertu de son positionnement en bas de la 18e colonne du tableau, mais il s'agirait en fait d'un solide semiconducteur aux propriétés voisines d'un métalloïde, tandis que l'élément 114Uuq, qui devrait être un métal pauvre en bas de la 14e colonne, aurait plutôt les propriétés d'un gaz rare.
Le copernicium 112Cn, situé parmi les métaux de transition, aurait également des propriétés le rapprochant des gaz rares et serait d'ailleurs gazeux.

















































