Structure des protéines - Définition
La liste des auteurs de cet article est disponible ici.
Structure secondaire
La structure secondaire décrit le repliement local de la chaîne principale d'une protéine. L'existence de structures secondaires vient du fait que les repliements énergétiquement favorables de la chaîne peptidique sont limités et que seules certaines conformations sont possibles. Ainsi, une protéine peut être décrite par une séquence d'acides aminés mais aussi par un enchaînement d'éléments de structure secondaire.
De plus certaines conformations se trouvent nettement favorisées car stabilisée par des liaisons hydrogènes entre les groupements amide (-NH) et carbonyle (-CO) du squelette peptidique. Il existe trois principales catégories de structures secondaires selon l'échafaudage de liaisons hydrogènes, et donc selon le repliement des liaisons peptidiques : les hélices, les feuillets et les coudes.
Il existe des méthodes expérimentales pour déterminer la structure secondaire comme la résonance magnétique nucléaire, le dichroïsme circulaire ou certaines méthodes de spectroscopie infrarouge.
Angles dièdres et structure secondaire
La chaîne principale contient trois liaisons covalentes par acide aminé. La liaison peptidique étant une liaison plane, il reste deux liaisons simples autour desquelles la rotation est possible. On peut donc déterminer la conformation du squelette d'un acide aminé à partir de deux angles dièdres, φ et ψ.
- L'angle dièdre φ est défini par les quatre atomes successifs du squelette : CO-NH-Cα-CO, le premier carbonyle étant celui du résidu précédent.
- L'angle dièdre ψ est défini par les quatre atomes successifs du squelette : NH-Cα-CO-NH, le second amide étant celui du résidu suivant.
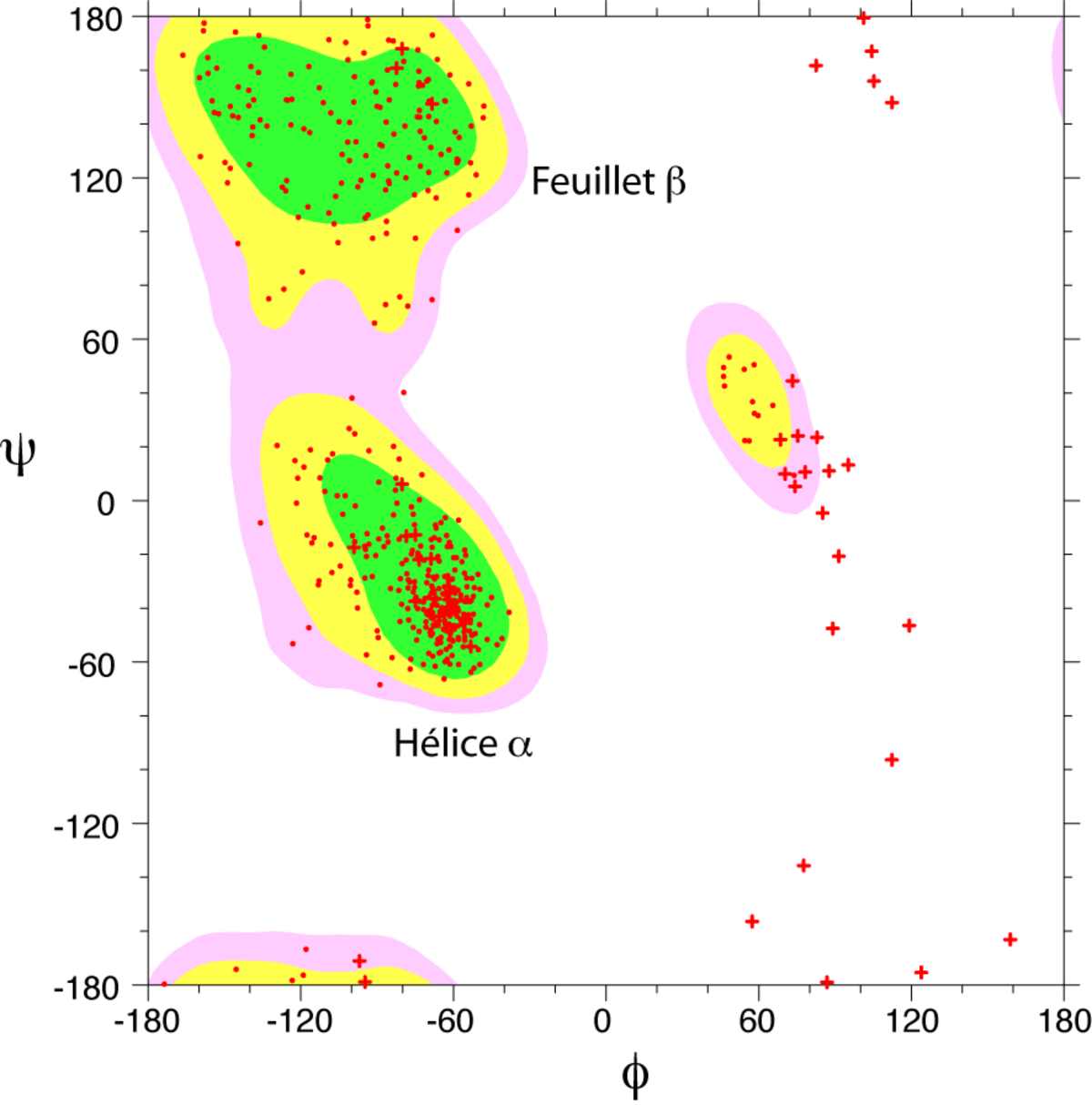
Toutes les valeurs des angles φ et ψ ne sont pas possibles car certaines conduisent à des contacts trop proches entre atomes qui sont énergétiquement très défavorables. Une étude systématique des combinaisons admissibles d'angles φ et ψ a été réalisé par le biologiste et physicien indien Gopalasamudram Narayana Ramachandran en 1963. Il a imaginé une représentation sous forme graphique de l'espace (φ ,ψ) qui porte aujourd'hui le nom de diagramme de Ramachandran. Ce diagramme montre trois principales zones énergétiquement favorables. Lorsqu'on analyse une structure de protéine, on observe que la majeure partie des acides aminés ont des combinaisons d'angles (φ ,ψ) qui s'inscrivent à l'intérieur de ces zones. Les deux principales régions correspondent aux structures secondaires régulières qui sont principalement observées dans les protéines : la région des hélices α et celle des feuillets β. La troisième région, plus petite, correspond à une conformation en hélice gauche (φ>0).
Il y a deux acides aminés particuliers qui font exception à cette règle du diagramme de Ramachandran : la Glycine et la Proline. La glycine ne possède pas de chaîne latérale (R=H) et, de ce fait, est beaucoup moins contrainte sur le plan de l'encombrement stérique. Elle peut donc adopter des valeurs (φ ,ψ) beaucoup plus diversifiées, en dehors des régions normalement privilégiées. À l'inverse, la proline est plus contrainte: elle contient un cycle pyrrole qui empêche la rotation correspondant à l'angle φ.
Hélice
Il y a conformation en hélice lorsque le squelette principal de la protéine adopte un repliement hélicoïdal périodique. Dans l'immense majorité des cas, cette hélice tourne dans le sens horaire. Elle est alors dite « droite ». Inversement, lorsqu'une hélice tourne dans le sens anti-horaire, elle est dite « gauche ».
Il existe aussi des enroulements superhélicoïdaux où 2 hélices, voire plus, s'enroulant l'une autour de l'autre pour former une superhélice. Ce type de conformation, ou faisceau d'hélices (coiled-coil) n'est pas une structure secondaire mais bien un type particulier de structure tertiaire, présent en particulier dans les protéines formant des fibres (e.g. fibrine, kératine, myosine).
Hélice α
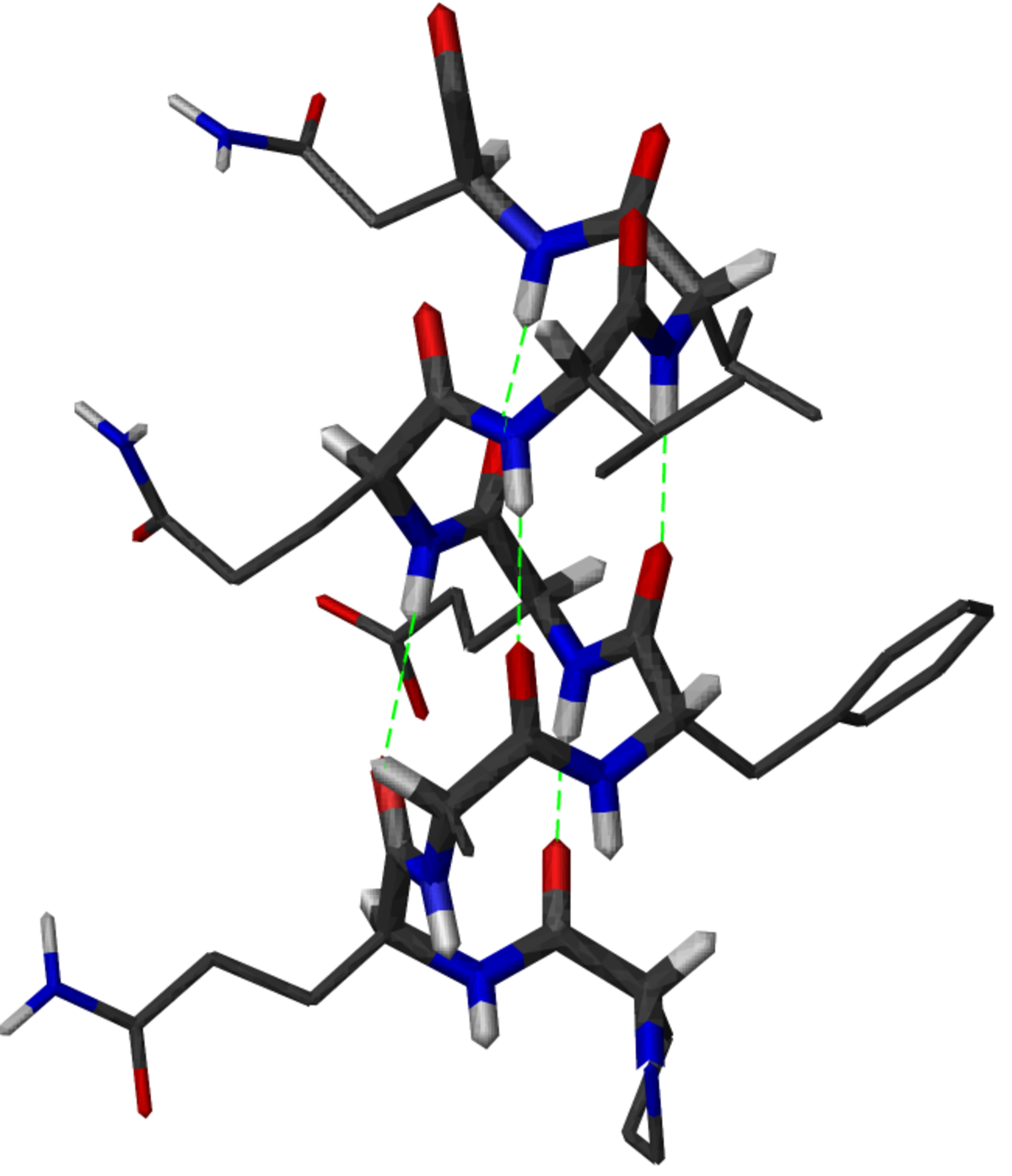
L'hélice α est une structure périodique très fréquente dans le repliement des protéines et des peptides. Elle se caractérise par la formation de liaisons hydrogènes entre le groupement carbonyle -CO d'un résidu i et le groupement amide -NH d'un résidu i+4. Un tour d'hélice α moyen contient 3,6 résidus et mesure 0.54 nm, soit une translation de 0.15 nm par résidu. Les angles dièdres φ et ψ de la chaîne peptidique sont en moyenne de -57° et -47° dans une hélice α.
Dans une hélice α, les chaînes latérales des acides aminés sont localisées en périphérie de l'hélice et pointent vers l'extérieur (voir figure). C'est une structure compacte, énergétiquement favorable.
La structure de l'hélice α a été prédite par Linus Pauling et Robert Corey en 1951, à partir de considérations théoriques, avant d'être observée effectivement pour la première fois en 1958 dans la myoglobine, la première protéine dont la structure tridimensionnelle a été résolue par cristallographie.
Hélice 310
L'hélice 310 se caractérise par la formation d'une liaison hydrogène entre le groupement -CO d'un résidu i et le groupement -NH d'un résidu i+3. Un pas d'hélice 310 moyen contient 3 résidus et mesure 0.60 nm, soit une translation de 0.2 nm par résidu. Les angles dièdres φ et ψ des liaisons peptidiques sont en moyenne de -49.0° et -26.0°. Le tour d'hélice 310 est donc plus étroit et plus contraint que celui de l'hélice α. Ce type de conformation est peu fréquent et sa longueur dépasse rarement 1 à 2 tours.
Hélice π
L'hélice π se caractérise par la formation d'une liaison hydrogène entre le groupement CO d'un résidu i et le groupement NH d'un résidu i+5. Un pas d'hélice π moyen contient 4 résidus et mesure 0.50 nm, soit une translation de 0.11 nm par résidu. Les angles dièdres φ et ψ des liaisons peptidiques sont en moyenne de -57.1° et -69.7°. Le tour d'hélice π est donc plus large que celui de l'hélice α. Ce type de conformation est très rare.
Hélice de type II
Les hélices de type II sont des hélices gauches formées par des poly-glycines ou des poly-prolines. Un pas moyen d'hélice de type II contient 3 résidus et mesure 0.93 nm, soit une translation de 0.31 nm par résidu. Les angles dièdres φ et ψ des liaisons peptidiques sont en moyenne de -79.0° et +145.0°.
Brin et feuillet β
Le brin β est une structure périodique étendue. Les liaisons hydrogènes qui le stabilisent se font entre résidus distants plutôt qu'entre résidus consécutifs, comme dans le cas de l'hélice α. En fait, un brin β seul n'est pas stable. Il a besoin de former des liaisons hydrogènes avec d'autres brins β pour se stabiliser. On parle alors de feuillets β. Un brin β est une structure de période 2, dont les chaînes latérales sont situées alternativement en dessus et en dessus du plan du feuillet. Grossièrement, le brin β peut être vu comme une hélice avec un pas de 2 acides aminés.
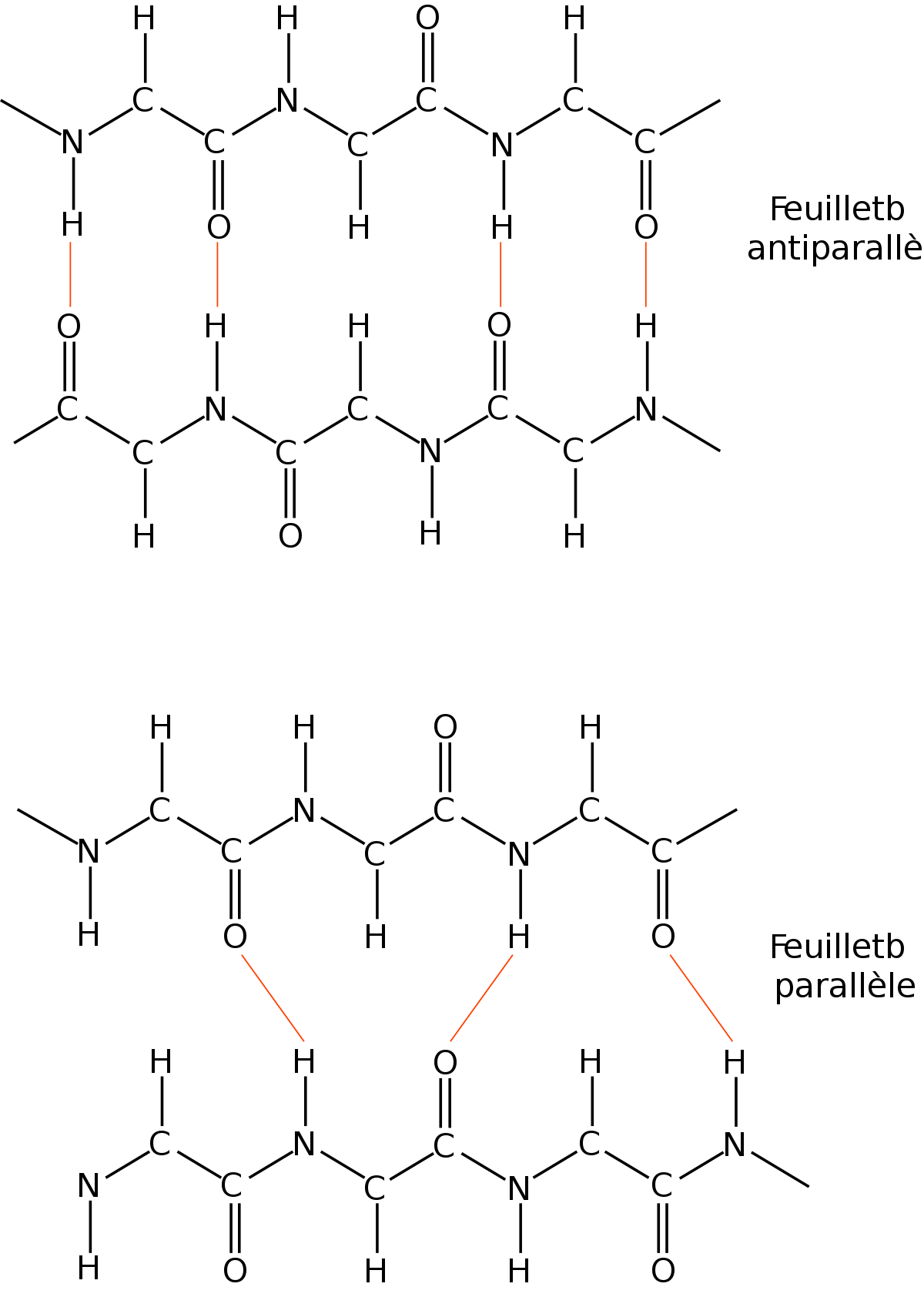
Les brins β composant un feuillet ont une polarité, celle de la chaîne peptidique qui va du N-terminal vers le C-terminal. Lors de l'agencement de deux brins adjacents dans un feuillet, deux topologies sont possibles : soit les deux brins ont la même orientation, soit ils ont des orientations opposées. Dans le premier cas, on parle de brins parallèles et dans le dernier de brins anti-parallèles.
Les feuillets β ne sont pas plans, ils présentent un plissement sur leur surface, avec des plis alternativement orientés vers le haut et vers le bas.
Feuillet β anti-parallèle
Lorsque les brins β s'organisent de manière tête-bêche, ils forment un feuillet β anti-parallèle. Les groupements -NH et -CO d'un résidu i d'un brin A forment des liaisons hydrogènes avec les groupements -CO et -NH d'un résidu j d'un brin B. Typiquement, 2 brins β consécutifs relié par un coude forment un feuillet β anti-parallèle. Un brin β moyen dans un feuillet anti-parallèle mesure 0.68 nm, soit une translation de 0.34 nm par résidu. Les angles dièdres φ et ψ des liaisons peptidiques sont en moyenne de -139.0° et +135.0°.
Feuillet β parallèle
Lorsque les brins β sont tous orientés dans le même sens, ils se forment en un feuillet β parallèle. Ainsi, 2 brins β consécutifs ne peuvent former un feuillet β parallèle. Les groupements -NH et -CO d'un résidu i d'un brin A forment des liaisons hydrogènes avec les groupements -CO d'un résidu et -NH d'un résidu j+2 appartenant à un brin B. Un brin β moyen dans un feuillet parallèle mesure 0.64 nm, soit une translation de 0.32 nm par résidu, Les angles dièdres φ et ψ des liaisons peptidiques sont en moyenne de -119.0° et +113.0°.
Un feuillet β est bien souvent composé de brins parallèles et anti-parallèles. Les feuillets β peuvent être plats mais ont plutôt tendance à former une structure légèrement gauche.
Coudes
Les coudes ne sont pas des structures périodiques. Il s'agit plutôt d'un repliement particulier du squelette carboné localisé à 3 ou 4 résidus consécutifs. Les coudes permettent bien souvent de relier 2 structures secondaires périodiques (hélices et/ou brins). Ils peuvent s'oxyder.
Coudes de type I, II et III
| ||||||||||||||||||||||||
| ||||||||||||||||||||||||
Dans les coudes de type I, II et III, il y a formation d'une liaison hydrogène entre le groupe -CO d'un résidu i et les groupement -NH d'un résidu i+3. Ces coudes courent donc sur 4 résidus. Ils sont regroupés sous l'appellation de coude β car ils font souvent le lien entre 2 brins β. Le tableau 1 récapitules les angles φ et ψ privilégiés des résidus au centre du coude.
Un coude de type III correspond à un tour d'hélice 310.
Certains acides aminés ont tendance à être favorisés à certaines positions des coudes selon leur encombrement stérique et/ou les angles dièdres qu'ils peuvent former (voir Tableau 2).
Il existe également des coudes de type I', II' et III' qui sont les images miroir des coudes décrit ci-dessus. Leurs angles dièdres sont les opposés de ceux décrits dans le Tableau 1.
Coude γ
Dans les coudes γ, il y a formation d'une liaison hydrogène entre le groupe -CO d'un résidu i et les groupement -NH d'un résidu i+2. Ces coudes courent donc sur 3 résidus. Les angles φ et ψ du résidu i+1 sont de +80.0° et -65.0°, respectivement. Il existe des coudes γ' avec des angles dièdres de -80.0° et +65.0°
Autres structures secondaires
Lorsque la conformation locale d'un segment protéique ne correspond à aucune de ces structures secondaires, on dit qu'il adopte une conformation en pelote statistique non périodique (random coil), par opposition aux hélices et aux feuillets qui sont des structures périodiques. Ce type de structure est le plus souvent associé aux boucles présentes entre 2 hélices ou feuillets. Pelote statistique ne signifie pas pour autant absence de structuration. Ainsi, certaines protéines ne possèdent aucun élément de structure secondaire régulière (hélice ou feuillet) mais ont une structure parfaitement stable. C'est souvent le cas des hormones et toxines polypeptidiques.