Spectrométrie de masse - Définition
La liste des auteurs de cet article est disponible ici.
La source d'ionisation
Les ionisations EI et CI, qui nécessitent un certain niveau de vide, sont préférentiellement utilisées en couplage avec la chromatographie en phase gazeuse (la CI fonctionnant à partir d'une source EI). En revanche, les deux sources à pression atmosphérique (électrospray et APCI) dites à "ionisation douce", sont principalement utilisées en couplage avec la chromatographie en phase liquide.
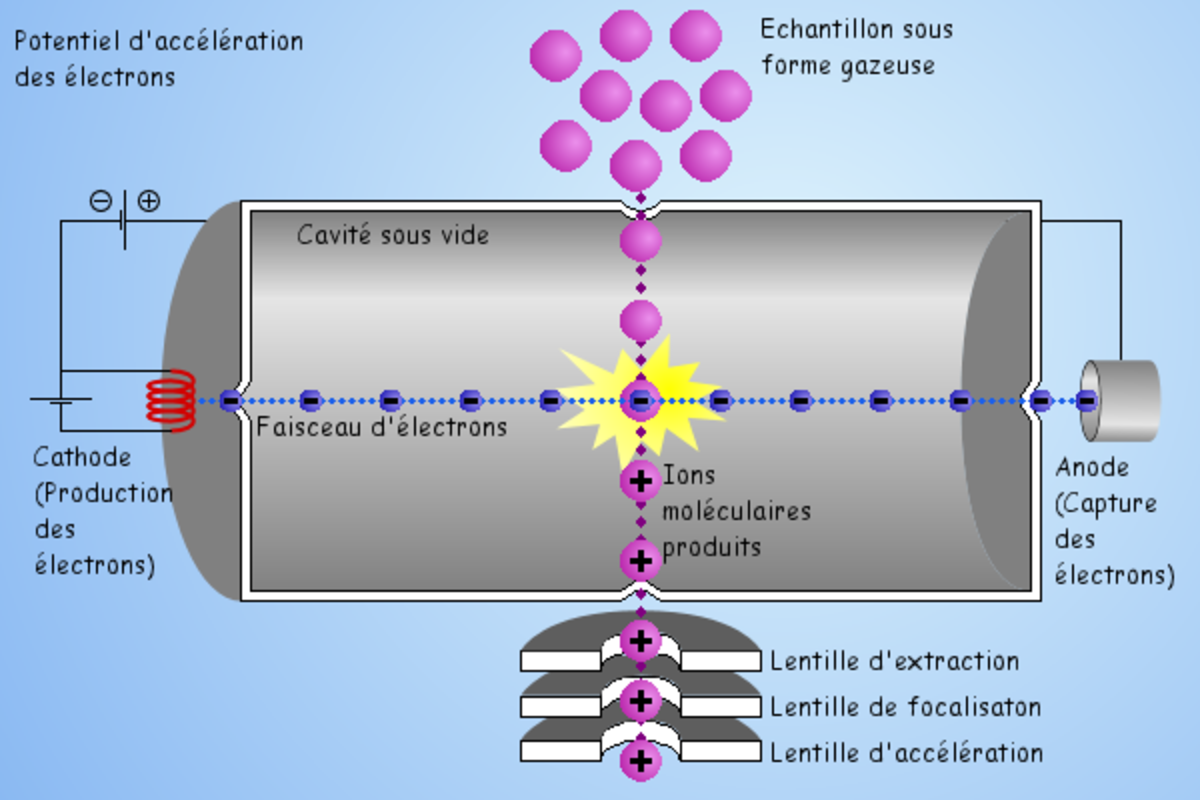
L'ionisation électronique (EI)
Des électrons émis par un filament rencontrent les molécules qui entrent dans la source : lors de la rencontre, si l'énergie cinétique des électrons est suffisante, un électron est arraché de la molécule M, la transformant en un ion radical M+o. Celui-ci peut ensuite se fragmenter suivant son énergie interne. L'EI conduit ainsi à un spectre assez fourni, avec de nombreux fragments, très riche en informations structurales.
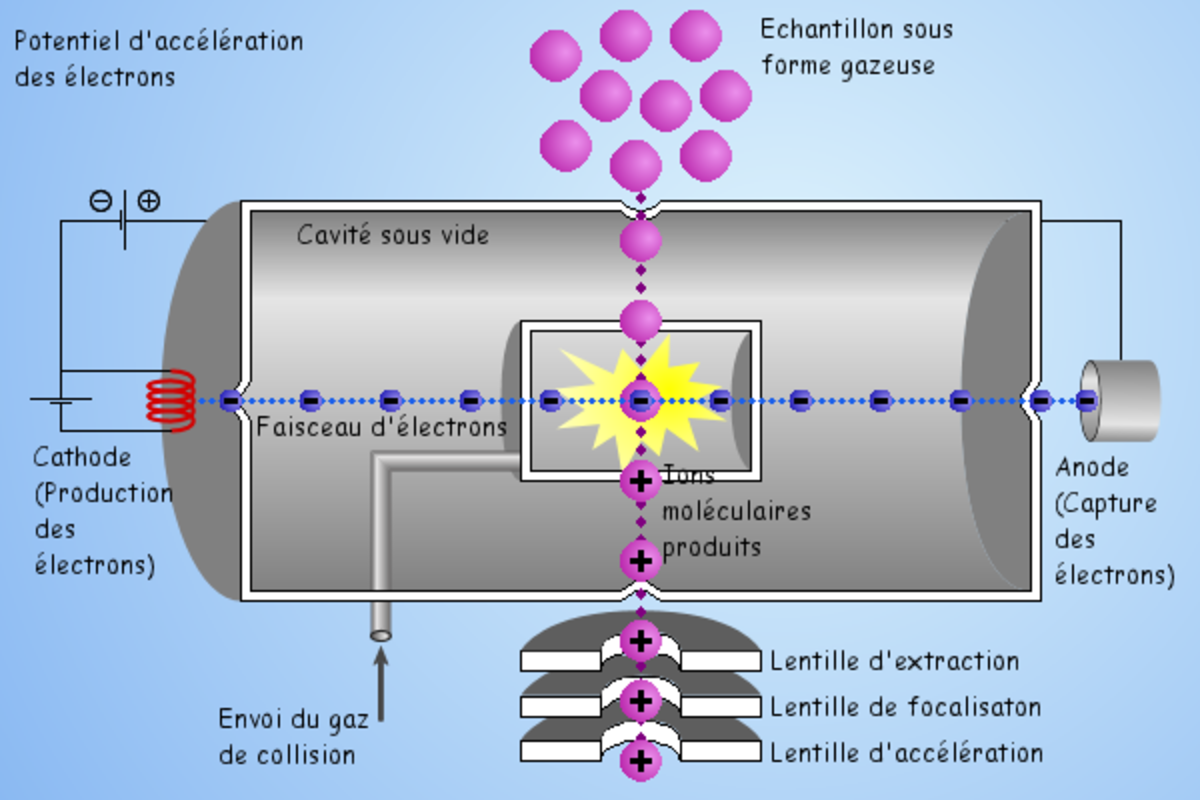
L'ionisation chimique (CI)
En plus du dispositif EI ci-dessus, un gaz réactif est introduit dans la source et ionisé par impact électronique. S'ensuit une série de réactions qui donne naissance à des ions pouvant réagir avec les molécules d'analyte arrivant dans la source. Ce type de réactions ions-molécules produit principalement (en mode positif) des ions [MH] +, et [M+adduit+H]+, permettant ainsi d'accéder à la masse moléculaire de l'analyte.
Le méthane, l'isobutane et l'ammoniac sont parmi les gaz d'ionisation chimique les plus utilisés.
Pour la détection de molécules globalement électronégatives, comportant des parties halogénées ou fluorogénées, on peut faire appel à l'ionisation chimique négative. Le principe est de charger négativement ces molecules en les bombardant d'électrons qui seront capturés par les atomes électroattracteurs. Du fait de la forte probabilité de capture de l'electron, ce type d'ionisation peut être 1000 fois plus sensible que l'ionisation chimique positive
L'ionisation par bombardement d'atomes rapides (FAB)
Elle permet d'analyser des molécules non vaporisables sous vide (grosses molécules biologiques). L'ionisation est effectuée par expulsion en phase vapeur des ions contenus dans un échantillon liquide suite à un bombardement d'atomes rapides (Ar ou Xe). Les molécules ainsi ionisées n'ont pas beaucoup d'énergie interne, la fragmentation est donc faible mais l'ion moléculaire est facilement reconnaissable et la masse moléculaire est facile à déterminer. L'échantillon est mélangé en solution à une matrice liquide non volatile (glycérol,thioglycérine, alcool m-nitrobenzylique). Un faisceau à haute énergie (de l'ordre de 4 à 10 keV) d'atomes neutres (Ar ou Xe) est envoyé sur l'échantillon et la matrice dans la chambre de collision causant ainsi les phénomènes de désorption et d'ionisation. Les ions préexistants en solution sont expulsés en phase gazeuse et accélérés vers l'analyseur.
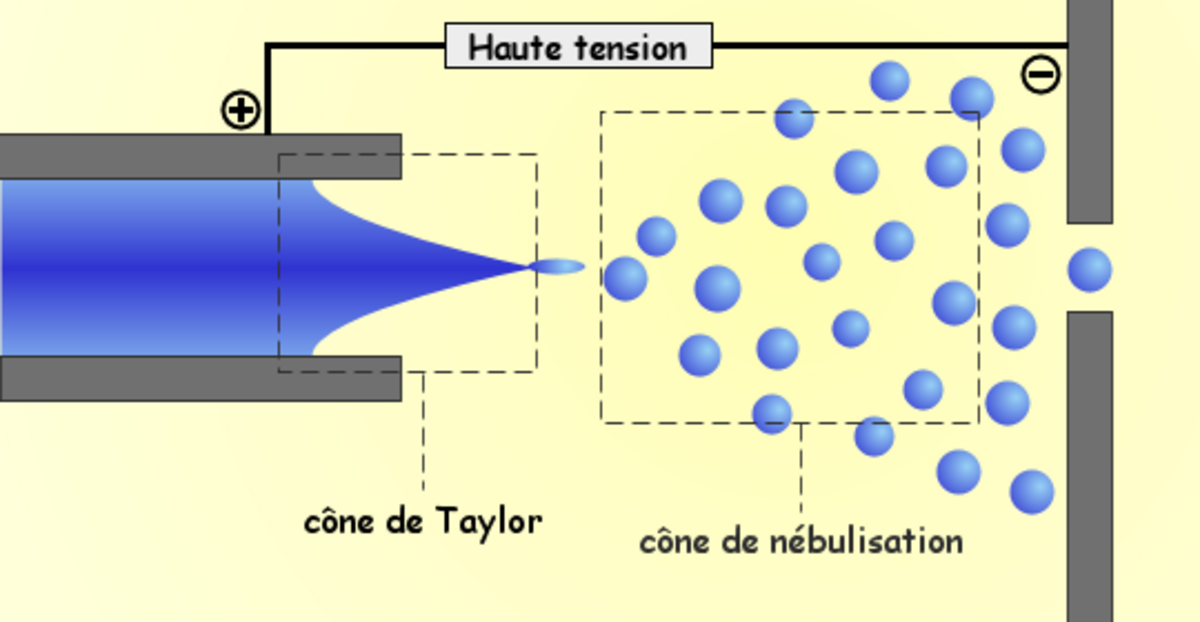
L'ionisation par électronébulisation (électrospray) (ESI)
Son principe est le suivant : à pression atmosphérique, les gouttelettes de solutés sont formées à l'extrémité d'un fin capillaire porté à un potentiel élevé. Le champ électrique intense leur confère une densité de charge importante. Sous l'effet de ce champ et grâce à l'assistance éventuelle d'un courant d'air co-axial, l'effluent liquide est transformé en nuage de fines gouttelettes (spray) chargées suivant le mode d'ionisation. Sous l'effet d'un second courant d'air chauffé, les gouttelettes s'évaporent progressivement. Leur densité de charge devenant trop importante, les gouttelettes explosent en libérant des microgouttelettes constituées de molécules protonées ou déprotonées de l'analyte, porteuses d'un nombre de charges variable.
Les ions ainsi formés sont ensuite guidés à l'aide de potentiels électriques appliqués sur deux cônes d'échantillonnage successifs faisant office de barrières avec les parties en aval maintenues sous un vide poussé (<10-5 Torr). Durant ce parcours à pression élevée, les ions subissent de multiples collisions avec les molécules de gaz et de solvant, ce qui complète leur désolvatation. En faisant varier les potentiels électriques appliqués dans la source il est possible de provoquer des fragmentations plus ou moins importantes.
L'avantage de cette méthode d'ionisation comme pour l'APCI est l'obtention d'ions multichargés, pour les macromolécules, polymères. Elle permet d'autre part de générer une ionisation "douce" : des ions moléculaires sont formés en majorité.
L'ionisation chimique à pression atmosphérique (APCI)
Les échantillons liquides sont directement introduits dans un nébuliseur pneumatique. Sous l'effet d'un jet d'air ou d'azote, le liquide est transformé en fin brouillard. Un chauffage assure la désolvatation des composés. Ces derniers sont ensuite ionisés chimiquement à pression atmosphérique : en général, la phase mobile vaporisée joue le rôle de gaz d'ionisation et les électrons sont obtenus à partir de décharges d'électrode couronne. L'ionisation des composés est très favorisée lors de ces techniques car la fréquence des collisions est élevée à pression atmosphérique.
L'APCI est une technique analogue à l'ionisation chimique (CI), elle fait appel à des réactions ions-molécules en phase gazeuse, mais à pression atmosphérique et conduit essentiellement à la formation d'ions [MH]+ ou [M-H]-.
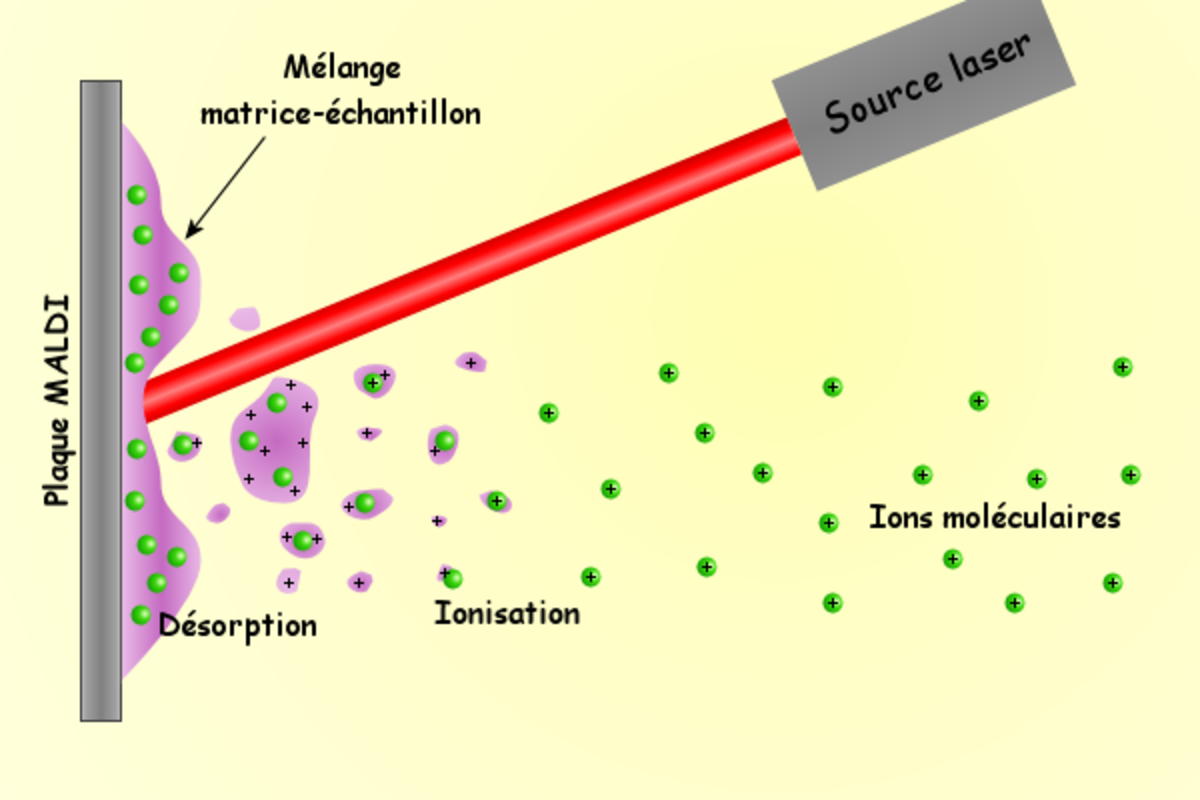
La désorption-ionisation laser assistée par matrice (MALDI)
Un faisceau laser pulsé est utilisé, généralement dans le domaine des ultraviolets, pour désorber et ioniser un mélange matrice/échantillon cocristallisé sur une surface métallique, la cible.
Les molécules de matrice absorbent l'énergie transmise par le laser sous forme de photons UV, s'excitent et s'ionisent. L'énergie absorbée par la matrice provoque sa dissociation et son passage en phase gazeuse. Les molécules de matrice ionisées transfèrent leur charge à l'échantillon. L'expansion de la matrice entraîne l'échantillon au sein de la phase gazeuse dense où il va finir de s'ioniser.
L'ionisation de l'échantillon a donc lieu soit dans la phase solide avant la désorption, soit par transfert de charge lors de collisions avec la matrice excitée après désorption. Elle conduit à la formation d'ions monochargés et multichargés de type [M+nH]n+, avec une nette prépondérance pour les monochargés.