Sonic hedgehog - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
La Sonic hedgehog (SHH) est chez les mammifères l'une des trois protéines impliquées dans la voie de signalisation nommée Hedgehog. Les deux autres facteurs de cette voie étant DHH (Desert Hedgehog Homolog) et IHH (Indian Hedgehog Homolog). La protéine SHH est le ligand de la voie de signalisation Hedgehog le mieux étudié. Il joue un rôle clé dans la régulation de l'organogénèse des vertébrés , tels que la croissance des doigts sur les membres et l'organisation du cerveau.
La protéine Sonic hedgehog est le meilleur exemple de morphogène tel que défini par Lewis Wolpert et son modèle du drapeau français, c'est-à-dire une molécule qui diffuse selon un gradient de concentration et qui a des effets différents sur les cellules de l'embryon en formation en fonction de sa concentration : Face à la BMP, elle contribue à l'établissement de la polarité dorso-ventrale de l'embryon. La SHH reste importante chez l'adulte, en contrôlant la division cellulaire des cellules souches adultes et est impliquée dans le développement de certains cancers.
Pour sa part, André Gernez préconise de tarir la sécrétion de la STH à l'âge adulte pour réduire le risque de maladies dégénératives.
Découverte
Le gène hedgehog (hh) fut tout d'abord identifié et publié en 1978 par Eric Wieschaus (1947-) et Christiane Nusslein-Volhard (1942-) du laboratoire Européen de Biologie Moléculaire (EMBL) d'Heidelberg (Allemagne). Leur recherche sur le développement embryonnaire de la drosophile, également appelée mouche du fruit ou mouche du vinaigre, leur permettra d'obtenir le Prix Nobel de physiologie ou médecine en 1995 (conjointement au généticien du développement, Edward B.Lewis).
Expérience: greffe hétérotopique de notocorde
On s'est aperçu que la notocorde, située au dessous du tube neural, spécifie la plaque du plancher (plaque située sous le tube neural). On détecte dans la partie ventrale la présence de motoneurones. Si on greffe la notocorde d'un autre coté, on s'aperçoit qu'il y a induction de la plaque du plancher, mais aussi des motoneurones.
La plaque du plancher spécifie donc les destins ventraux du tube neural, et ce en sécrétant un morphogène : SHH. En fonction de la concentration de SHH, des domaines différents sont spécifiés.
Modification post-transcriptionnelle
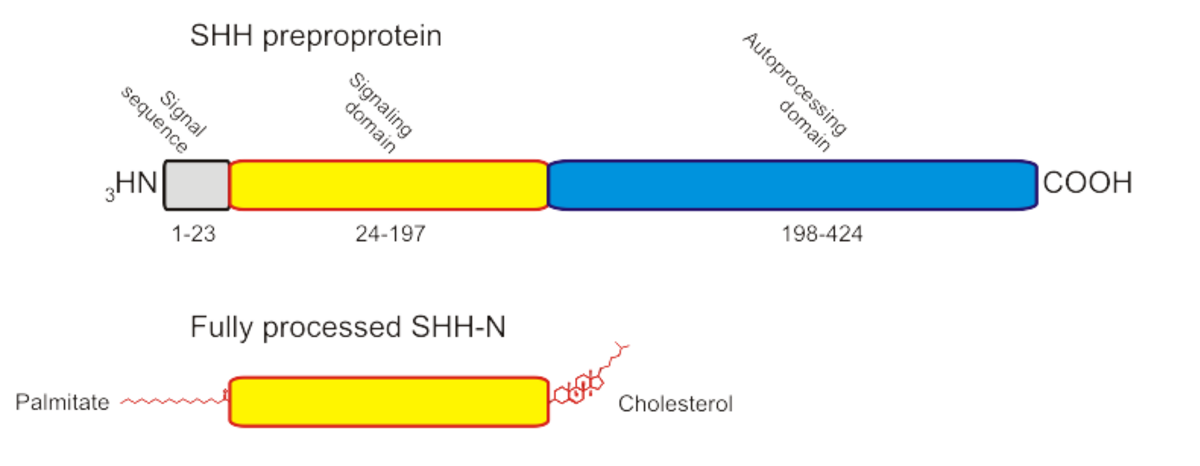
La protéine Sonic Hedgehog, codée par le gène hh localisé en 7q36, est synthétisée sous la forme d’une préproprotéine d’environ 45 kDa. Celle-ci contient une « séquence signale » (résidus 1 à 23) sur son N-terminal, qui est reconnue par la « Particule de reconnaissance du signal » (SRP) durant sa translocation dans le réticulum endoplasmique (ER). Une fois la translocation terminée, la séquence signale est retirée par une "signal peptidase".
Celle-ci est clivée par autoprotéolyse du C-terminal en deux polypeptides :
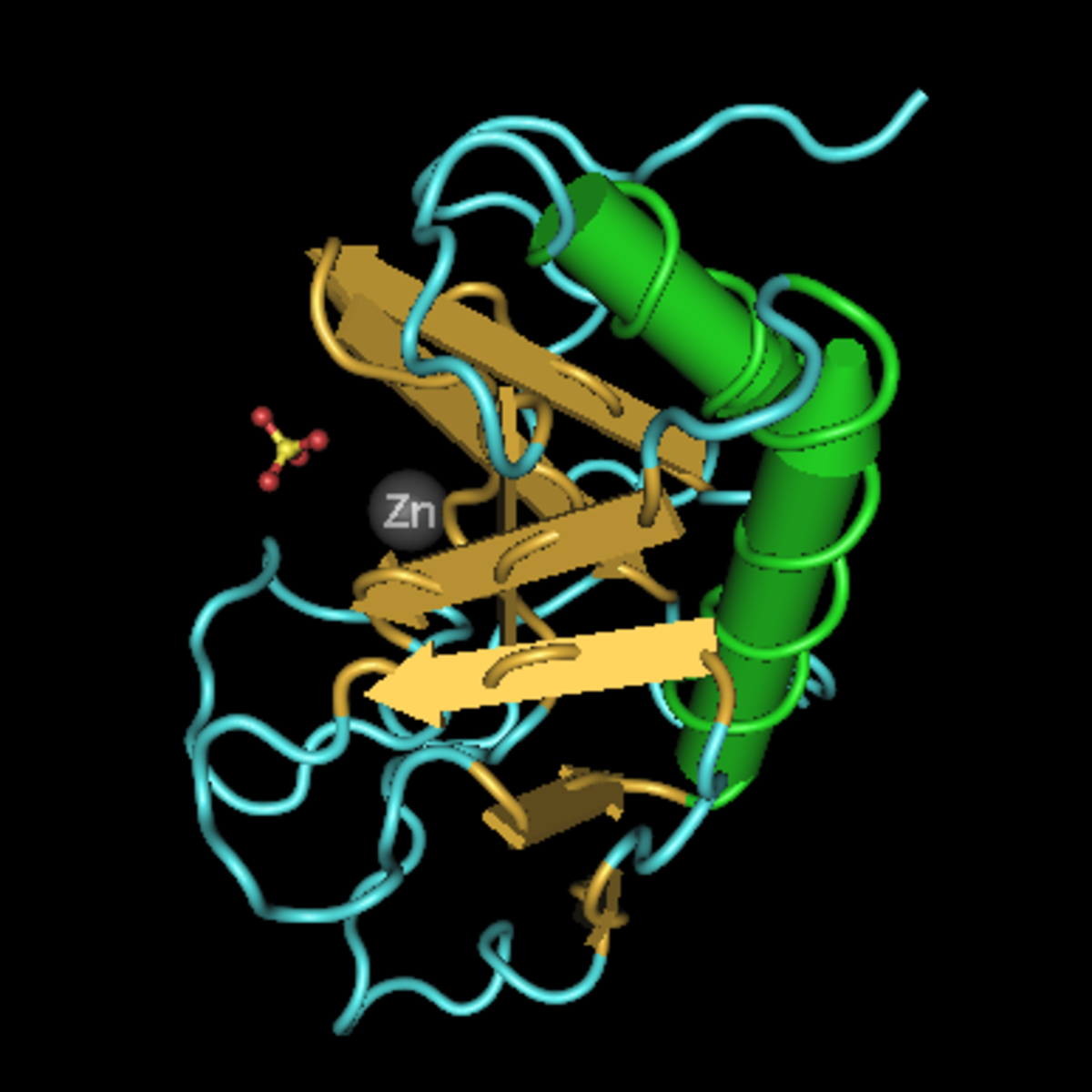
- Un domaine aminoterminal de 20 kDa (Shh-N) ayant une activité Zn hydrolase (résidus 24 à 197) ;
- Un domaine carboxy-terminal (Shh-C) de 25 kDa, auto-catalytique, doué d’une activité cholestérol transférase (résidus 198 à 462).
Durant cette réaction, un intermédiaire thioester va être formé. Celui-ci va subir une attaque nucléophile de la part d’une molécule de cholestérol, entrainant l’attachement du cholestérol au C-Terminal de Shh-N. Cette molécule de cholestérol permet l’ancrage de Hh-N à la surface de la cellule. Quand exprimée dans des cellules d’insectes ou de mammifères, la protéine Shh-N est soumise à une seconde modification lipidique : l’introduction du palmitoyl sur l’alpha-amine du N-terminal cystéine. L’activité biologique de cette forme « palmytilée » peut être 30 fois supérieure à la forme « non-palmytilée ». Shh-N ainsi modifiée est responsable de la totalité des activités signalisatrices identifiées pour les protéines Shh.
Il existe également d’autres formes de modifications hydrophobiques à la forme Shh-N telle que la substitution du résidu N-terminal cystéine par 2 résidus hydrophobiques Isoleucine. Ceux-ci peut également augmenter l’activité de Shh-N.