Séquençage de l'ADN - Définition
La liste des auteurs de cet article est disponible ici.
Méthode de Sanger
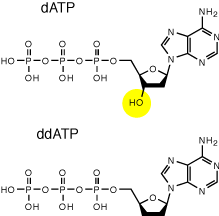
Le principe de cette méthode consiste à initier la polymérisation de l’ADN à l'aide d'un petit oligonucléotide (amorce) complémentaire à une partie du fragment d’ADN à séquencer. L’élongation de l’amorce est réalisée par le fragment de Klenow (une ADN polymérase I dépourvue d’activité exonucléase 5’→3’) et maintenant par des ADN polymérases thermostables, celles qui sont utilisées pour la PCR. Les quatre désoxyribonucléotides (dATP, dCTP, dGTP, dTTP) sont ajoutés, ainsi qu’en faible concentration de l'un des quatre didésoxynucléotides (ddATP, ddCTP, ddGTP ou ddTTP).
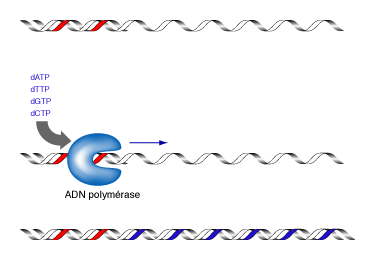
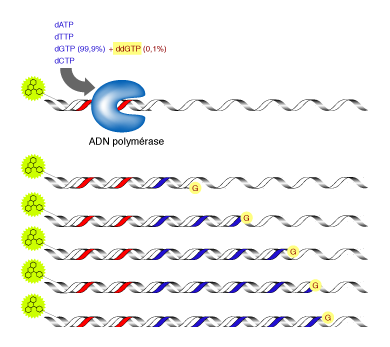
Ces didésoxynucléotides, agissent comme des « poisons » terminateurs de chaîne : une fois incorporés dans le nouveau brin synthétisé, ils empêchent la poursuite de l’élongation. Cette terminaison se fait spécifiquement au niveau des nucléotides correspondant au didésoxyribonucléotide incorporé dans la réaction. Pour le séquençage complet d'un même fragment d'ADN, on répète cette réaction quatre fois en parallèle, avec les quatre didésoxyribonucléotides différents.
Par exemple, dans la réaction où on a ajouté du ddGTP, la synthèse s'arrête au niveau des G. Le mélange réactionnel contenant, à la fois du dGTP et un peu de ddGTP, la terminaison se fait de manière statistique suivant que l'ADN polymérase utilise l'un ou l'autre de ces nucléotides. Il en résulte un mélange de fragments d’ADN de tailles croissantes, qui se terminent tous au niveau d'un des G dans la séquence. Ces fragments sont ensuite séparés par électrophorèse sur un gel de polyacrylamide, ce qui permet ainsi de repérer la position des G dans la séquence.
La détection des fragments ainsi synthétisés se fait en incorporant un traceur dans l'ADN synthétisé. Initialement ce traceur était radioactif, aujourd'hui, on utilise des traceurs fluorescents, attachés soit à l'oligonucléotide, soit au didésoxyribonucléotide.
Autres méthodes
- Utilisation des puces à ADN.
- ....
Séquençage de génome entier
La connaissance de la structure d'un génome dans son entièreté peut passer par son séquençage. Cependant, la taille des génomes étant de plusieurs millions de bases (ou mégabases), il est nécessaire de coupler les approches de biologie moléculaire avec celle de l'informatique pour pouvoir traiter un nombre aussi important de données.
Deux grands principes de séquençage de génome entier sont utilisés. Dans les deux cas, l'ADN génomique est préalablement fragmenté par des méthodes enzymatiques (enzymes de restriction) ou physiques (ultrasons).
- la première méthode de séquençage dites par ordonnancement hiérarchique consiste à classer les fragments génomiques obtenus avant de les séquencer
- la seconde méthode dite globale (ou whole-genome shotgun), ne fait pas de classement des fragments génomiques obtenus mais les séquence dans un ordre aléatoire. Une analyse bio-informatique permet ensuite de réordonner les fragments génomiques par chevauchement des séquences communes.
La principale différence entre ces deux principes est que l'ordonnancement hiérarchique essaie d'aligner un jeu de clones de grande taille (~ 100 kb) alors que dans la méthode globale le génome entier est réduit en fragments de petite taille qui sont séquencés puis alignés.
Ordonnancement hiérarchique
Après extraction, l'ADN génomique est découpé par sonication en fragments de 50 à 200 kb puis cloné dans un vecteur adapté comme les chromosomes artificiels bactériens ou BAC. Le nombre de clones doit permettre une couverture de 5 à 10 fois la longueur totale du génome étudié. Le chevauchement et l'ordonnancement des clones est réalisé soit par hybridation de sondes spécifiques, soit par analyse des profils de restriction, soit plus fréquemment par un ordonnancement après séquençage et hybridation des extrémités des BAC. Après avoir effectué l'ordonnancement des clones, ils sont fragmentés et séquencés individuellement, puis assemblés par alignement bio-informatique.
Les avantages de cette méthode sont une plus grande facilité d'assemblage des fragments grâce aux chevauchement des BAC, la possibilité de comparer les fragments aux banques de données disponibles, et la possibilité de partager le travail de séquençage entre plusieurs laboratoires, chacun ayant en charge une région chromosomique.
L'inconvénient majeur est la difficulté de cloner des fragments contenant des séquences répétés très fréquentes dans certains génomes, comme ceux des mammifères, ce qui rend difficile l'analyse bio-informatique finale.
Méthode globale
Il s'agit d'une méthode de séquençage d'ADN génomique initialement imaginée dans le laboratoire de Frederick Sanger à Cambridge à la fin des années 70 pour séquencer les premiers génomes de virus.
Cette méthode a été popularisée par Craig Venter pour le sequénçage des grands génomes, en particulier au sein de la société Celera Genomics. La première application fut le séquençage de génomes bactériens, puis du génome de la drosophile et enfin du génome humain et murin.
Pour réaliser un séquençage de génome complet à l'aide de cette technique, deux à trois banques composées de fragments aléatoires d'ADN génomique sont réalisées. Entre les banques, les fragments divergent aussi bien en taille qu'en localisation sur le génome. À partir de ces banques, de nombreux clones sont séquencés puis assemblés. La séquence totale est obtenue en traitant l'ensemble des banques à l'aide d'outils bio-informatiques, en alignant les fragments à l'aide des séquences chevauchantes.
Les avantages par rapport au séquençage par ordonnancement hiérarchique sont la rapidité de la technique et un coût plus faible. L'inconvénient est que le traitement informatique ne permet pas d'aligner des fragments comportant des séquences répétées de grande taille qui sont fréquemment présentes dans les génomes des mammifères.
Cette méthode est couramment désignée sous le nom de shotgun (fusil à canon scié), ou encore Whole Genome Shotgun (WGS). Cette métaphore illustre le caractère aléatoire de la fragmentation initiale de l'ADN génomique : on arrose tout le génome, un peu comme se dispersent les plombs de ce type d'arme à feu.

















































