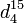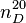Saccharose - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Saccharose | |
|---|---|
| |
| Général | |
| Nom IUPAC | |
| Synonymes | néohancoside D reiniose Fru ß(2↔1)α Glc |
| No CAS | |
| No EINECS | |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | solide de forme variable blanc. |
| Propriétés chimiques | |
| Formule brute | C12H22O11 |
| Masse molaire | 342,2965 ± 0,0144 g·mol-1 |
| pKa | 12,62 |
| Moment dipolaire | 3,1×10-18 C·m |
| Propriétés physiques | |
| T° fusion | 185,5 °C |
| T° ébullition | décomposition |
| Solubilité | 67,47 %m (eau, 25 °C) Modérément sol. dans la pyridine, le glycérol, la méthylpyrrolidinone, la méthylpipérazine, le DMSO, le DMF; |
| Masse volumique |
|
| Propriétés électroniques | |
| constante diélectrique | 3,50–3,85 |
| Précautions | |
| | |
|
1 1 0 | |
| | |
| Produit non contrôlé | |
| Ingestion | favorise l'apparition de caries, à grandes doses: vomissements, diarrhées, dyspepsies |
| Écotoxicologie | |
| DL | 29,7 g·kg-1 (rats, oral) |
| LogP | -3,67 |
| Composés apparentés | |
| Autres composés | Isomaltulose, Leucrose, Maltulose, Tréhalulose, Turanose |
| | |
Le saccharose, ou saccarose, est plus simplement le sucre commercial extrait de la betterave sucrière ou de la canne à sucre. Le saccharose est une molécule organique composée de carbone, d'hydrogène et d'oxygène. Ce sucre est le constituant du sucre blanc courant.
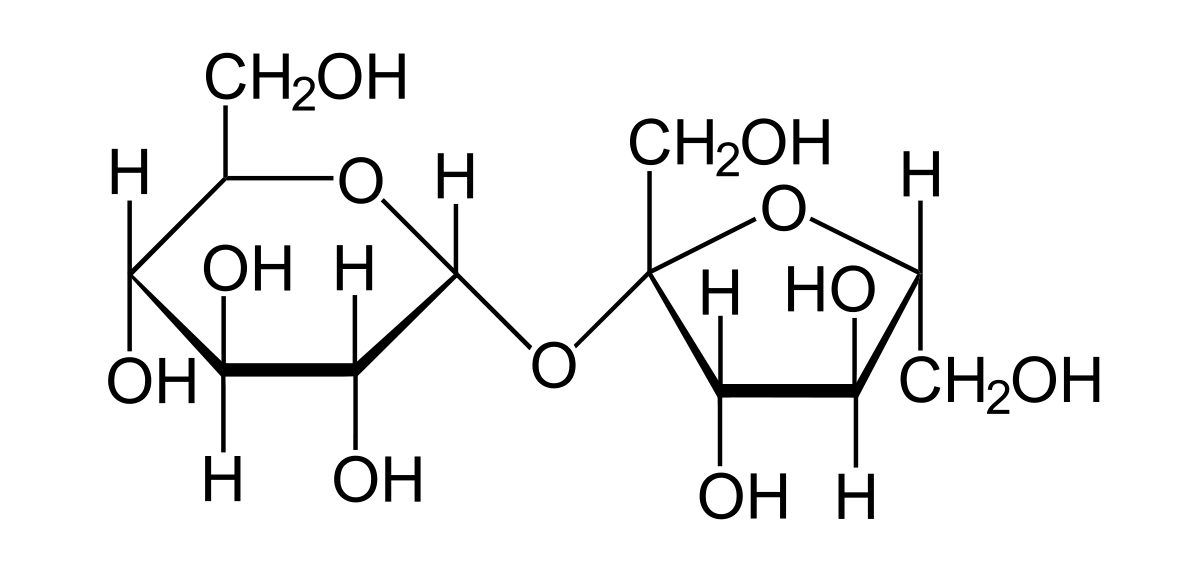
Le saccharose est un sucre double (diholoside) formé par la condensation de 2 oses : une molécule de glucose et une molécule de fructose. Son nom officiel est le β-D-fructofuranosyl-(2↔1)-α-D-glucopyranoside. Il peut être symbolisé par Glc-Fru.
Propriétés
Structure
Le saccharose est un diholoside formé d'une molécule de glucose et d'une molécule de fructose reliées par une liaison osidique α(1↔2)β. Sa formule chimique non-développée est C12H22O11 et sa masse molaire est de 342,3 g.mol-1.
Le saccharose a 5 isomères naturels qui différent par la position de la liaison osidique :
- Tréhalulose ⇒ Glucose α(1→1) Fructose
- Turanose ⇒ Glucose α(1→3) Fructose (diholoside réducteur)
- Maltulose ⇒ Glucose α(1→4) Fructose
- Leucrose ⇒ Glucose α(1→5) Fructose (diholoside réducteur)
- Isomaltulose (Palatinose) ⇒ Glucose α(1→6) Fructose (diholoside réducteur)
Propriétés chimiques
Le saccharose est un sucre non réducteur, le carbone hémiacétalique du glucose et le carbone hémiacétalique du fructose sont impliqués dans la liaison osidique. Il est non hygroscopique. Il ne peut effectuer de mutarotation et il n'est pas réducteur.
Hydrolyse
Il existe plusieurs types d'hydrolyses :
- L'hydrolyse chimique (en milieu acide)
- L'hydrolyse par résine échangeuse d'ion, cette technique permettant de contrôler le pourcentage de saccharose qui sera inverti.
- L'hydrolyse enzymatique. Elle est fonction de la température, du pH et de la concentration. Les deux enzymes entrant en jeu sont l'α-glucosidase et la β-fructosidase ou invertine.
En présence d'eau et à température modérée, soit 37 °C, le saccharose, par l'effet de l'enzyme invertase, s'hydrolyse en glucose et en fructose, ce qui permet son assimilation par l'organisme.
Le mélange produit par l'hydrolyse est un mélange équimolaire de glucose et de fructose, appelé sucre inverti. Il est néanmoins exceptionnel de trouver un sirop dans lequel la réaction a été complète et on trouvera souvent jusqu'à 30% de saccharose résiduel.
Propriétés physiques
Le saccharose caramélise à 160 °C.
La variation de la solubilité avec la température est donnée dans le tableau ci-dessous :
| température | g de saccharose par g d'eau | pourcentage massique | pourcentage molaire |
|---|---|---|---|
| -10 °C | 1,7615 | 63,79 %m | 8,484 %mol |
| -5 °C | 1,7837 | 64,08 %m | 8,582 %mol |
| 0 °C | 1,8127 | 64,45 %m | 8,710 %mol |
| 5 °C | 1,8489 | 64,90 %m | 8,868 %mol |
| 10 °C | 1,8926 | 65,43 %m | 9,059 %mol |
| 15 °C | 1,9443 | 66,04 %m | 9,283 %mol |
| 20 °C | 2,0047 | 66,72 %m | 9,544 %mol |
| 25 °C | 2,0741 | 67,47 %m | 9,842 %mol |
| 30 °C | 2,1535 | 68,29 %m | 10,180 %mol |
| 35 °C | 2,2435 | 69,17 %m | 10,561 %mol |
| 40 °C | 2,3450 | 70,10 %m | 10,986 %mol |
| 45 °C | 2,4589 | 71,09 %m | 11,459 %mol |
| 50 °C | 2,5863 | 72,12 %m | 11,981 %mol |
| 55 °C | 2,7282 | 73,18 %m | 12,556 %mol |
| 60 °C | 2,8857 | 74,26 %m | 13,185 %mol |
| 65 °C | 3,0598 | 75,37 %m | 13,871 %mol |
| 70 °C | 3,2515 | 76,48 %m | 14,613 %mol |
| 75 °C | 3,4616 | 77,59 %m | 15,411 %mol |
| 80 °C | 3,6901 | 78,68 %m | 16,263 %mol |
| 85 °C | 3,9368 | 79,74 %m | 17,164 %mol |
| 90 °C | 4,2003 | 80,77 %m | 18,104 %mol |
| 95 °C | 4,4775 | 81,74 %m | 19,071 %mol |
| 100 °C | 4,7637 | 82,65 %m | 20,046 %mol |
| 105 °C | 5,0335 | 83,43 %m | 20,944 %mol |
| 110 °C | 5,4499 | 84,50 %m | 22,290 %mol |
| 115 °C | 5,9347 | 85,58 %m | 23,801 %mol |
| 120 °C | 6,5062 | 86,68 %m | 25,508 %mol |
| 125 °C | 7,1895 | 87,79 %m | 27,452 %mol |
| 130 °C | 8,0211 | 88,91 %m | 29,685 %mol |
La solubilité du saccharose dans les solvants non aqueux est généralement inférieure. De plus, le saccharose n'est pas soluble dans les solvants non polaires. Des valeurs élevées sont obtenues avec l'ammoniac condensé (72%), le diméthylsulfoxyde (42%) et la méthylamine (>25%). On obtient des valeurs plus basses avec le dioxyde de soufre liquide, les acides formique et acétique, le diméthylformamide, la pyridine (6%), le propylène glycol, le glycérol (7%), le méthanol, l'éthanol, l'acétone et le dioxane.
Le taux de sucre est donné par le degré Brix (qui correspond au pourcentage massique à 20 °C). On peut évaluer la concentration d'une solution aqueuse en mesurant la densité à l'aide d'un mustimètre ou l'indice de réfraction à l'aide d'un réfractomètre.
La variation de quelques propriétés de la solution aqueuse à 20°C est donnée dans le tableau ci-dessous :
| pourcentage massique | molalité (moles par kg d'eau) | molarité (moles par litre de solution) | masse volumique | indice de réfraction | température de fusion | viscosité dynamique |
|---|---|---|---|---|---|---|
| 0,5 %m | 0,015 mol·kg-1 | 0,015 mol·l-1 | 1,0002 g·cm-3 |
| -0,03 °C | 1,015 mPa·s |
| 1 %m | 0,03 mol·kg-1 | 0,029 mol·l-1 | 1,0021 g·cm-3 |
| -0,06 °C | 1,028 mPa·s |
| 2 %m | 0,06 mol·kg-1 | 0,059 mol·l-1 | 1,006 g·cm-3 |
| -0,11 °C | 1,055 mPa·s |
| 3 %m | 0,09 mol·kg-1 | 0,089 mol·l-1 | 1,0099 g·cm-3 |
| -0,17 °C | 1,084 mPa·s |
| 4 %m | 0,122 mol·kg-1 | 0,118 mol·l-1 | 1,0139 g·cm-3 |
| -0,23 °C | 1,114 mPa·s |
| 5 %m | 0,154 mol·kg-1 | 0,149 mol·l-1 | 1,0178 g·cm-3 |
| -0,29 °C | 1,146 mPa·s |
| 6 %m | 0,186 mol·kg-1 | 0,179 mol·l-1 | 1,0218 g·cm-3 |
| -0,35 °C | 1,179 mPa·s |
| 7 %m | 0,22 mol·kg-1 | 0,21 mol·l-1 | 1,0259 g·cm-3 |
| -0,42 °C | 1,215 mPa·s |
| 8 %m | 0,254 mol·kg-1 | 0,241 mol·l-1 | 1,0299 g·cm-3 |
| -0,49 °C | 1,254 mPa·s |
| 9 %m | 0,289 mol·kg-1 | 0,272 mol·l-1 | 1,034 g·cm-3 |
| -0,55 °C | 1,294 mPa·s |
| 10 %m | 0,325 mol·kg-1 | 0,303 mol·l-1 | 1,0381 g·cm-3 |
| -0,63 °C | 1,336 mPa·s |
| 12 %m | 0,398 mol·kg-1 | 0,367 mol·l-1 | 1,0465 g·cm-3 |
| -0,77 °C | 1,429 mPa·s |
| 14 %m | 0,476 mol·kg-1 | 0,431 mol·l-1 | 1,0549 g·cm-3 |
| -0,93 °C | 1,534 mPa·s |
| 16 %m | 0,556 mol·kg-1 | 0,497 mol·l-1 | 1,0635 g·cm-3 |
| -1,1 °C | 1,653 mPa·s |
| 18 %m | 0,641 mol·kg-1 | 0,564 mol·l-1 | 1,0722 g·cm-3 |
| -1,27 °C | 1,79 mPa·s |
| 20 %m | 0,73 mol·kg-1 | 0,632 mol·l-1 | 1,081 g·cm-3 |
| -1,47 °C | 1,945 mPa·s |
| 22 %m | 0,824 mol·kg-1 | 0,7 mol·l-1 | 1,0899 g·cm-3 |
| -1,67 °C | 2,124 mPa·s |
| 24 %m | 0,923 mol·kg-1 | 0,771 mol·l-1 | 1,099 g·cm-3 |
| -1,89 °C | 2,331 mPa·s |
| 26 %m | 1,026 mol·kg-1 | 0,842 mol·l-1 | 1,1082 g·cm-3 |
| -2,12 °C | 2,573 mPa·s |
| 28 %m | 1,136 mol·kg-1 | 0,914 mol·l-1 | 1,1175 g·cm-3 |
| -2,37 °C | 2,855 mPa·s |
| 30 %m | 1,252 mol·kg-1 | 0,988 mol·l-1 | 1,127 g·cm-3 |
| -2,64 °C | 3,187 mPa·s |
| 32 %m | 1,375 mol·kg-1 | 1,063 mol·l-1 | 1,1366 g·cm-3 |
| -2,94 °C | 3,762 mPa·s |
| 34 %m | 1,505 mol·kg-1 | 1,139 mol·l-1 | 1,1464 g·cm-3 |
| -3,27 °C | 4,052 mPa·s |
| 36 %m | 1,643 mol·kg-1 | 1,216 mol·l-1 | 1,1562 g·cm-3 |
| -3,63 °C | 4,621 mPa·s |
| 38 %m | 1,791 mol·kg-1 | 1,295 mol·l-1 | 1,1663 g·cm-3 |
| -4,02 °C | 5,315 mPa·s |
| 40 %m | 1,948 mol·kg-1 | 1,375 mol·l-1 | 1,1765 g·cm-3 |
| -4,45 °C | 6,162 mPa·s |
| 42 %m | 2,116 mol·kg-1 | 1,456 mol·l-1 | 1,1868 g·cm-3 |
| -4,93 °C | 7,234 mPa·s |
| 44 %m | 2,295 mol·kg-1 | 1,539 mol·l-1 | 1,1972 g·cm-3 |
| 8,596 mPa·s | |
| 46 %m | 2,489 mol·kg-1 | 1,623 mol·l-1 | 1,2079 g·cm-3 |
| 10,301 mPa·s | |
| 48 %m | 2,697 mol·kg-1 | 1,709 mol·l-1 | 1,2186 g·cm-3 |
| 12,515 mPa·s | |
| 50 %m | 2,921 mol·kg-1 | 1,796 mol·l-1 | 1,2295 g·cm-3 |
| 15,431 mPa·s | |
| 60 %m | 4,382 mol·kg-1 | 2,255 mol·l-1 | 1,2864 g·cm-3 |
| 58,487 mPa·s | |
| 70 %m | 6,817 mol·kg-1 | 2,755 mol·l-1 | 1,3472 g·cm-3 |
| 481,561 mPa·s | |
| 80 %m | 11,686 mol·kg-1 | 3,299 mol·l-1 | 1,4117 g·cm-3 |
|
Propriétés édulcorante
Le pouvoir sucrant du saccharose sert de référence dans l'échelle des produits sucrants, c'est-à-dire qu'il est considéré comme égal à 1 par convention. Le seuil de reconnaissance moyen du sucrose est de 0,017 mol·l-1.