Rétrovirus endogène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Un rétrovirus endogène (ERV, de l'anglais endogenous retrovirus) désigne une séquence du génome d'un organisme stable (c'est-à-dire qui se transmet de génération en génération) et ayant des analogies avec certains rétrovirus (classés, eux, comme exogènes, car leur génome n'est pas présent dans celui de l'organisme).
L'étude des rétrovirus endogènes est un enjeu médical, car certains peuvent être source de maladies (dont des cancers) quand leur génome est exprimé malgré les protections naturelles mises en place au cours de l'évolution.
Prévalence chez les espèces
Des ERV ont été trouvés dans le génome de tous les eucaryotes étudiés, et sont généralement inactifs, et sans conséquence pathogène pour l'organisme.
Contrôle par l'organisme
On a récemment montré que l'expression de ces gènes dits « rétroéléments » est normalement inhibée par une protéine spécialisée dite « KAP 1 » responsable d'une méthylation des histones et ADN des rétroéléments, ce qui bloque (normalement définitivement) leur expression, et protège l'intégrité du reste du génome-hôte.
Plus précisément, la protéine KAP 1 joue un rôle de chef d'orchestre, en faisant appel à plusieurs protéines (histone-méthyltransférase ou SETDB1, Hétérochromatine HP1, complexe Histone-déacétylase NuRD et de nombreuse autres protéines).
Ce processus complexe est activé dès le début de l'embryogenèse, qui, d'ailleurs, ne pourrait se poursuivre sans la protéine KAP 1, en raison de l'apparition de mutations délétères conduisant à la mort rapide de l'embryon.
On espère que mieux comprendre ce processus puisse aider à contrôler des rétrovirus comme le VIH ou celui de l'Herpès (HSV), qui ne sont que provisoirement « endormis », par exemple pour pouvoir réveiller tous les virus endormis afin de les éliminer.
Origine
L'origine des ERV est incertaine. L'hypothèse la plus reprise est celle de l'infection de cellule germinales (qui participent à la production des gamètes et assurant ainsi la transmission de leur patrimoine génétique aux générations suivantes) par un rétrovirus.
La plupart des rétrovirus « infectent » des cellules somatiques, mais il peuvent aussi infecter des cellules germinales. Lorsque une telle infection a lieu et que les cellules survivent à l'infection (par exemple à cause d'une mutation du rétrovirus qui le rend défectif), le génome du rétrovirus peut être transmis à la génération suivante et persister dans la descendance au sein du génome de l'organisme sans avoir d'incidence notable sur son développement (ou les cas problématiques seraient éliminés par la sélection naturelle).
HERV
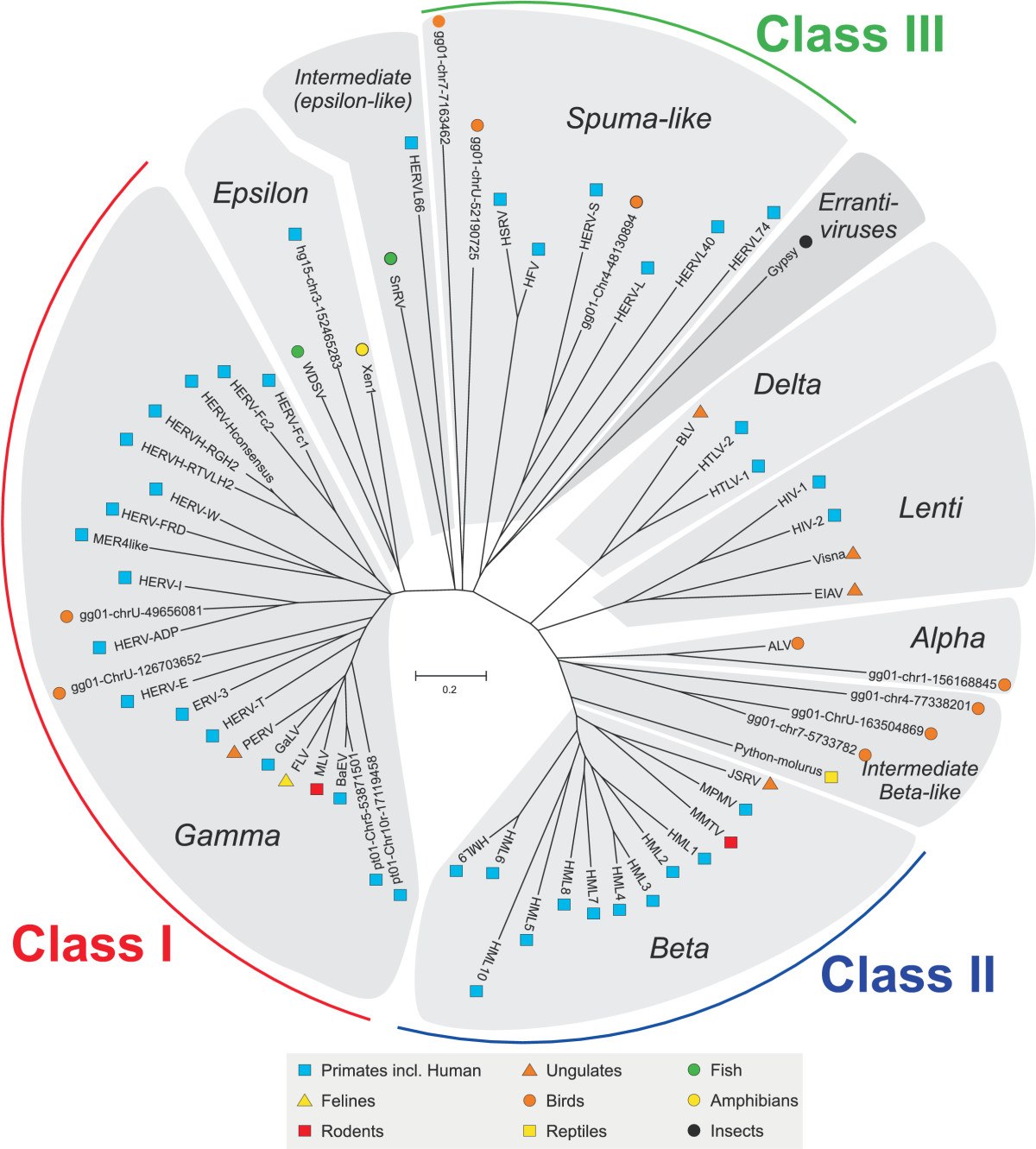
Les human endogenous retroviruses (HERV) n'ont été mis en évidences que depuis le séquençage du génome humain, et en représentent une partie importante (8 %, avec environ 98 000 éléments et fragments).
Les HERV sont classés en trois classes et plusieurs sous-groupes :
- classe I : apparentée aux gammarétrovirus
- classe II : apparentée aux bétarétrovirus
- classe III : apparentée aux spumavirus
Les rétrovirus des classes I et III sont plus anciens que ceux de la classe II, qui se seraient intégrés au génome du genre homo il y a environ cinq millions d'années.
Bien que fortement soupçonnés, il n'y avait, en 2003, aucune preuve claire que les rétrovirus endogènes soient responsables, ou même constituent un co-facteur, de diverses maladies, comme les cancers, les maladies auto-immunes ou certaines affections neurologiques.
HERV-K
HERV-K est une famille de rétrovirus endogènes qui a été intégré au génome humain il y au moins 30 millions d'années. Cette famille est particulièrement étudiée, car il semblerait qu'elle ait encore été active il y a peu de temps, la rendant idéale pour distinguer les différents mécanismes de prolifération au sein du génome.
En 2006, une équipe de chercheurs de l'Institut Gustave-Roussy, à Villejuif, en France), a réussi, à partir d'une trentaine d'éléments copiés par ces rétrovirus au sein du génome humain, à reconstituer un rétrovirus, qu'ils ont appelé Phœnix, et qui s'est révélé être capable d'assurer un cycle de réplication complet.

















































