Représentation des molécules - Définition
La liste des auteurs de cet article est disponible ici.
Notion de Liaison chimique
Ce paragraphe n'a pas pour but d'expliquer en détail ce qu'est une liaison chimique, ni de lister toutes les liaisons chimiques existantes. Plus d'informations à ce sujet ici
Dans cet article nous parlerons surtout des liaisons covalentes et des liaisons ioniques. Dans la réalité, une liaison chimique est très rarement purement covalente (c'est le cas d'une liaison entre deux atomes identiques comme par exemple dans la molécule de dihydrogène) ou purement ionique. La liaison réelle est un mélange de ces deux caractères.
Liaison covalente
Lorsque deux atomes sont liés par covalence il y a mise en commun d'un ou plusieurs doublets d'électrons, c'est-à-dire que deux (ou plus) électrons vont appartenir en même temps aux deux atomes. Il existe deux types de liaisons de covalence :
- La covalence pure : il y a mise en commun d'un doublet d'électrons, chaque atome apporte un électron initialement à l'état célibataire
- La covalence dative : il y a mise en commun d'un doublet d'électrons, un seul des deux atomes apportera le doublet
Liaison ionique
Les liaisons ioniques sont dues aux différences d'électronégativité (capacité à attirer les électrons) des atomes présents dans la molécule.
Pour comprendre ce qu'est une liaison ionique il faut considérer deux atomes liés entre eux. Si l'un est plus électronégatif alors il attirera les électrons de l'autre. L'atome plus électronégatif sera alors un peu chargé négativement, l'autre un peu positivement. Cette différence de charge créera une force électrostatique qui attirera les deux atomes (une charge positive et une charge négative s'attirent). Si cette différence d'électronégativité est très importante alors on parle de liaison ionique. La plupart des liaisons mettant en jeu deux éléments différents sont en partie ioniques, le caractère ionique étant généralement d'autant plus important que la différence d'électronégativité est importante.
Représentations spécifiques à la chimie organique
Ces représentations sont spécifiques à la chimie organique car elles utilisent des règles spécifiques aux liaisons carbone-carbone ou carbone-hydrogène.
Formule semi-développée (plane)
La formule semi-développée, comme son nom l'indique, est une forme condensée de la formule développée. On ne représente plus les liaisons Carbone-Hydrogène qui sont condensées sous forme de : CHn (avec n le nombre d'atomes d'hydrogène liés à l'atome de carbone). On représente les liaisons carbone-carbone et on distingue liaison simple et liaisons multiples.
Exemples
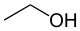
- CH3-CH2OH, la molécule d'éthanol.
- CH3-CO-CH3, la molécule d'acétone.
Formule topologique
La formule topologique est une manière simplifiée et rapide de représenter la structure d'une molécule organique.
On ne représente plus les atomes de carbone ni les atomes d'hydrogène portés par ces derniers. Les atomes d'hydrogène portés par des hétéroatomes (éléments autres que le carbone et l'hydrogène) sont représentés. Les liaisons carbone-carbone sont représentées par un trait oblique. Dans une formule topologique les atomes de carbone sont ainsi situés à l'intersection de deux segments. On fait la distinction entre liaisons multiples et liaisons simples : une liaison simple sera représentée par un trait, une liaison double par deux segments parallèles.
On représente la liaison entre les hétéroatomes, ou les groupes fonctionnels, et les carbones auxquels ils sont liés par un segment; on place le groupe fonctionnel, ou l'hétéroatome, à l'extrémité de ce segment. Les atomes d'hydrogène portés par les atomes de carbone n'étant pas représentés, un segment dont une extrémité n'est liée à aucun groupe fonctionnel correspond en fait à -CH3.
Exemples
Projection de Newman
La projection de Newman est très utile pour étudier les différentes conformations (on passe d'un conformère à un autre par rotation autour d'une liaison simple carbone-carbone) d'un composé organique. Cette projection est généralement utilisée uniquement avec des carbones tétravalents (liés à quatre autres atomes).
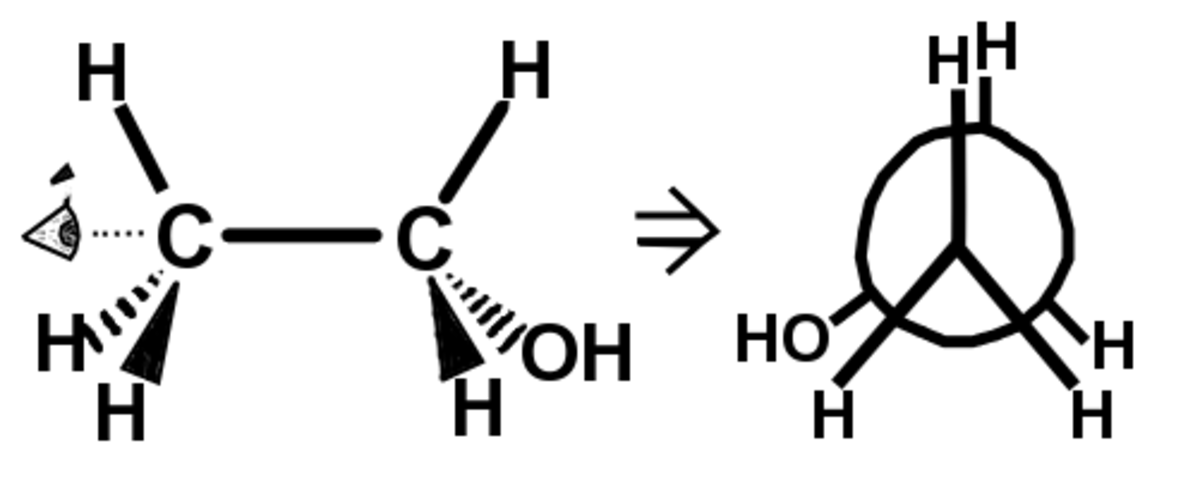
Pour représenter une molécule dans une projection de Newman il faut regarder la molécule dans l'axe d'une liaison simple carbone-carbone, on ne représente pas ces deux carbones dans une projection de Newman, mais les liaisons.
Les liaisons du carbone au premier plan sont représentées par trois segments partant du même point, les angles entre chacun de ces segments sont de 120° comme dans la réalité. Le carbone en arrière plan est représenté par un cercle sur lequel on place les trois liaisons restantes. (voir l'exemple)
Cette représentation permet de visualiser aisément les effets d'interactions stériques entre des groupements portés par deux carbones adjacents. Elle permet également de déterminer facilement la conformation Z ou E de l'alcène résultant d'une réaction d'élimination.
Exemple
-
Schéma descriptif du passage de la représentation de Cram à la représentation de Newman pour la molécule d'éthanol.
Projection de Fischer
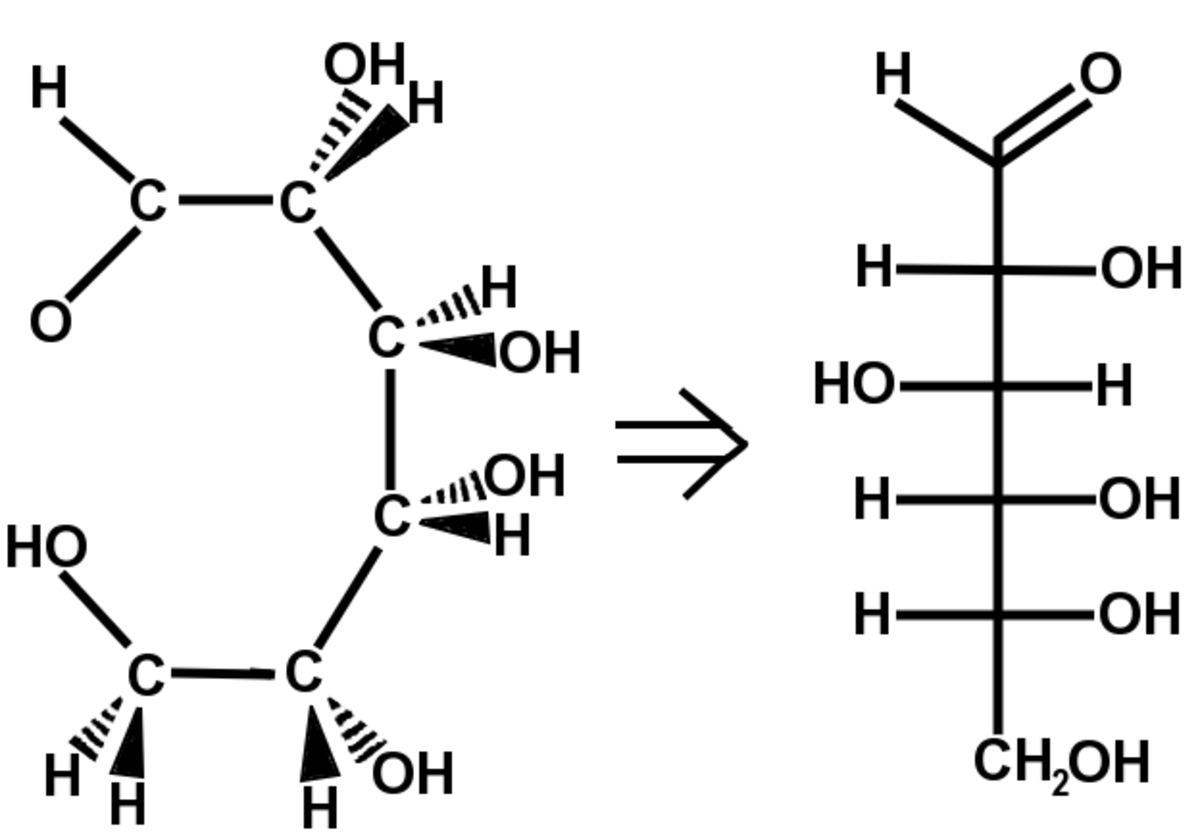
La projection de Fischer est surtout utilisée pour représenter les sucres et les acides aminés. Elle fut inventée par Hermann Emil Fischer.
On ne représente pas les atomes de carbone, ils sont situés à l'intersection des segments horizontaux et du trait vertical. La chaîne carbonée est représentée par la ligne verticale de manière à ce que les liaisons représentées sur la verticale s'éloignent du lecteur. Les liaisons représentées sur l'horizontale sortent du plan de la feuille vers le lecteur(voir l'exemple). Le carbone le plus oxydé se trouve en début de chaîne (en haut ici C=O).
Cette représentation permet de différencier facilement les énantiomères chiraux L ou D.
Exemple
-
Schéma du passage de la représentation de Cram à la projection de Fischer pour la molécule de D-Glucose
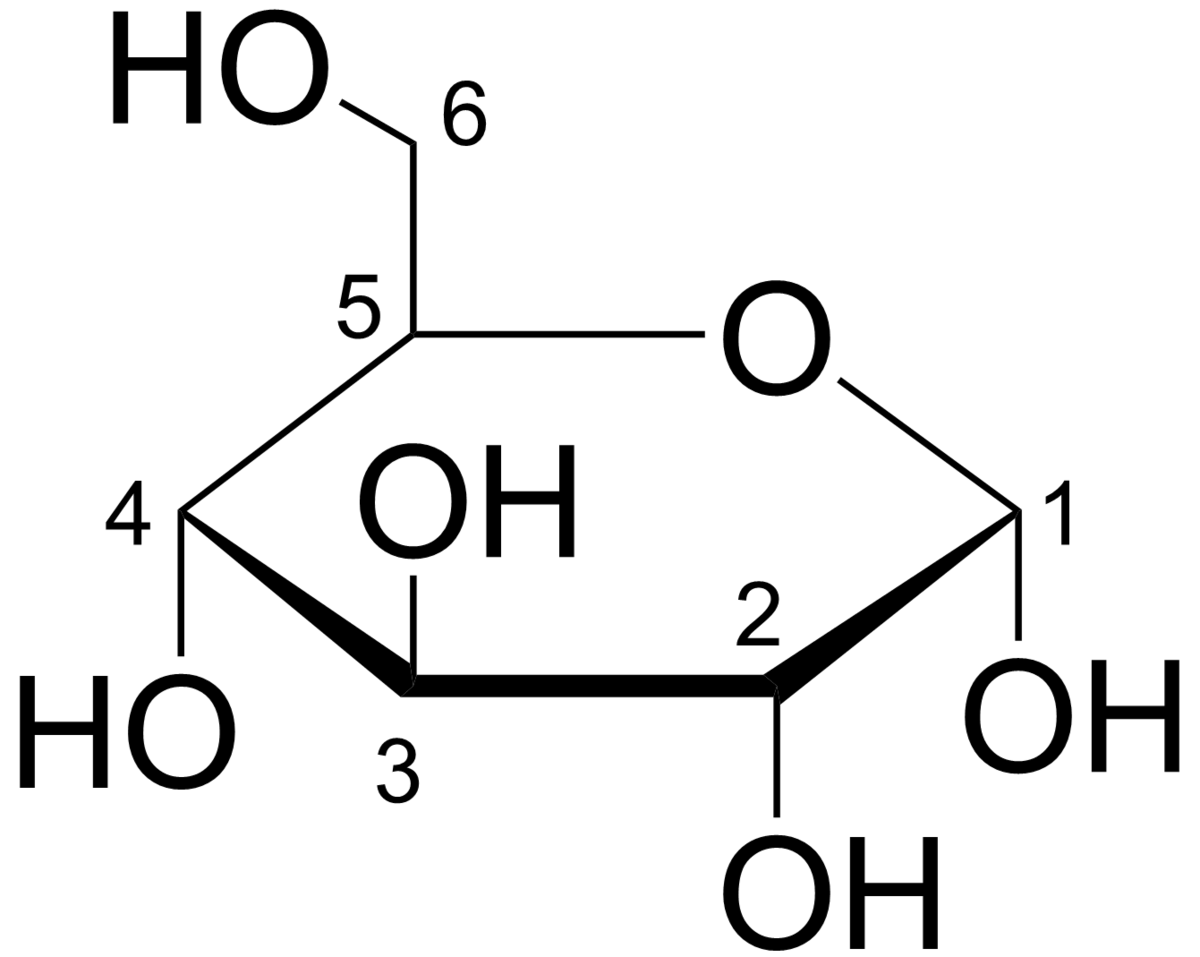
Projection de Haworth
La projection de Haworth permet de représenter la structure cyclique des oses (ou monosaccharides) avec une simple perspective tridimensionnelle.
Dans cette projection, on ne représente ni les atomes de carbone ni ceux d'hydrogène mais par contre, les liaisons carbone - carbone sont représentées par un trait. De plus, les liaisons les plus proches du lecteur sont en gras.
Exemple
Projection de Haworth du α--glucopyranose