Récepteurs couplés aux protéines G - Définition
La liste des auteurs de cet article est disponible ici.
Structure des récepteurs couplés aux protéines G
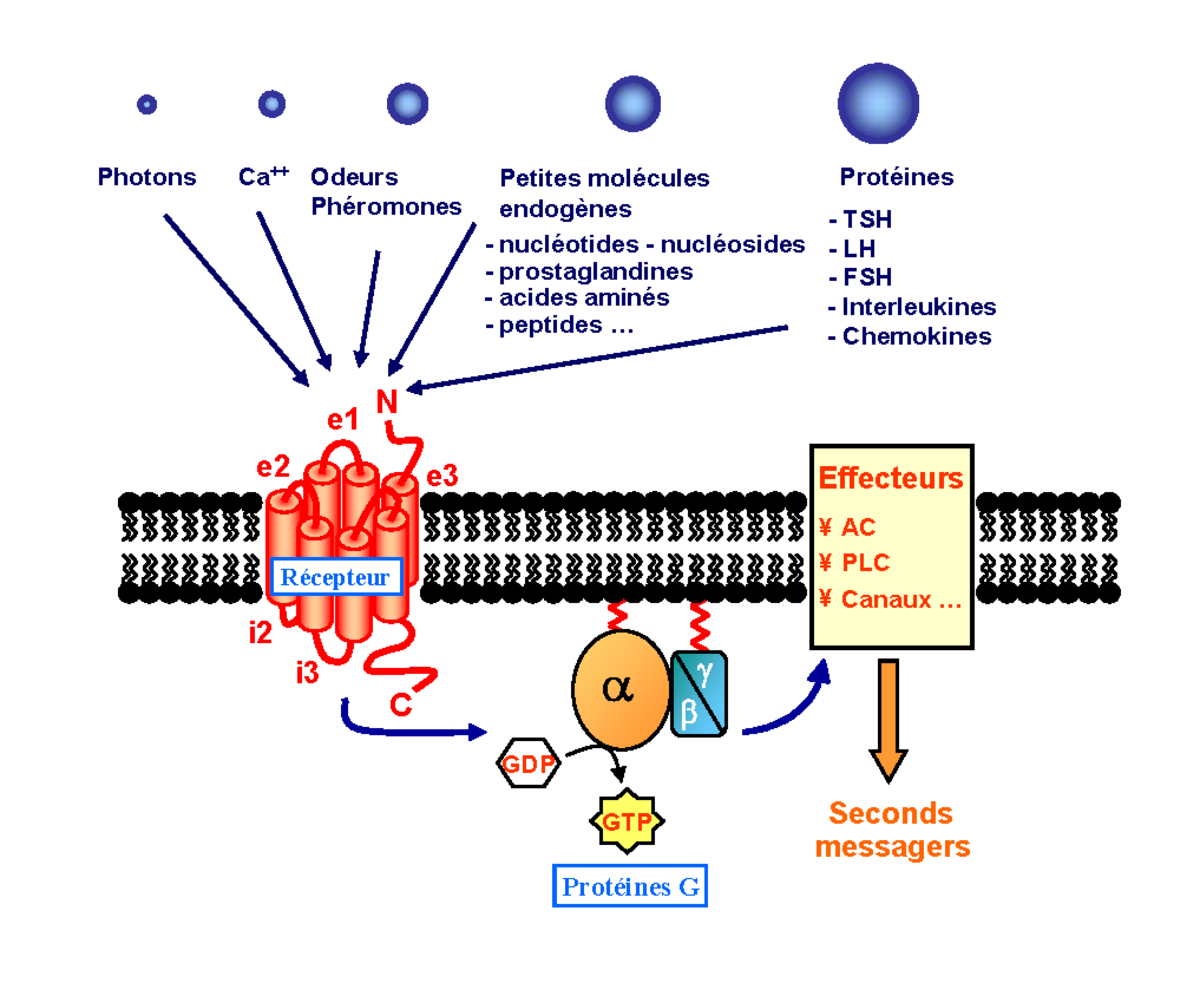
Les RCPG sont des protéines membranaires dont la masse moléculaire varie pour la plupart de 40 à 85 kDa (KiloDaltons). Il existe cependant des récepteurs beaucoup plus gros avec des masses moléculaires pouvant atteindre jusqu’à 620 kDa. Basés sur le modèle de la rhodopsine dont la structure tridimensionnelle a été résolue en 2000, les RCPG se caractérisent par une structure commune de sept hélices hydrophobes transmembranaires (TM), connectées par trois boucles extracellulaires et trois boucles intracellulaires (figure 1). Le domaine N-terminal orienté du côté extracellulaire est opposé au domaine C-terminal intracytoplasmique. Selon des homologies de séquences, les RCPG sont référencés en trois classes majeures (figure 2).
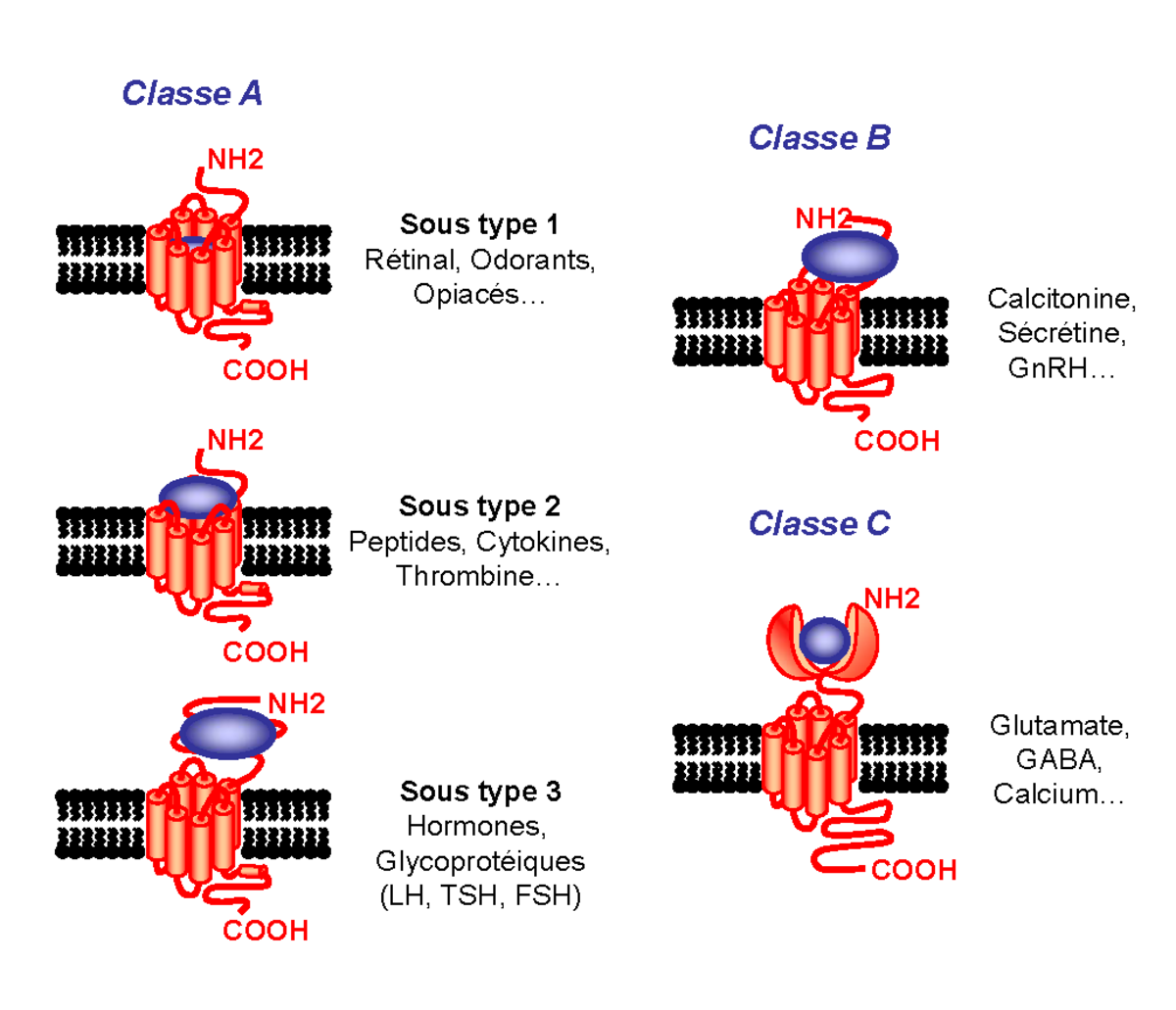
La classe A, avec comme archétype la rhodopsine, est la classe la plus représentée, composée entre autres des récepteurs aux catécholamines, chimiokines et glycoprotéines. Une vingtaine d’acides aminés très conservés représentent la signature de cette classe. Le haut degré de conservation de ces résidus sous-tend qu’ils pourraient jouer un rôle important dans la conservation de l’intégrité structurale et/ou fonctionnelle de ces récepteurs. Parmi ces acides aminés nous retiendrons l’aspartate du TMII et quatre résidus hydrophobes des TMVI et TMVII (proline, phénylalanine, asparagine) qui seraient importants pour l’activation des récepteurs ainsi que l’arginine du motif Asp-Arg-Tyr (DRY) entre le passage du TMIII et la boucle i2. À noter aussi la présence de deux cystéines sur les boucles extracellulaires e1/e2 engagées dans un pont disulfure et un site possible de palmitoylation après la courte hélice VIII située directement à la sortie du TMVII. Ce site de modification post-traductionnelle représente un point d’ancrage labile à la membrane plasmique pouvant former une quatrième boucle intracellulaire. Le site de liaison des ligands implique principalement les domaines transmembranaires ainsi que les boucles extracellulaires.
La classe B des RCPG se caractérise par un large domaine N-terminal extracellulaire (entre 100 et 500 acides aminés) contenant des cystéines conservées et engagées dans des ponts disulfures. Ces récepteurs sont capables de lier un grand nombre de peptides (calcitonine, sécrétine…) exclusivement au niveau des domaines extracellulaires (domaine N-terminal et boucles extracellulaires).
La classe C comprend les récepteurs du glutamate, de l’acide gamma-aminobutyrique (GABA), les récepteurs du calcium, trois récepteurs du goût, le récepteur GPRC6A ainsi que quelques récepteurs orphelins. Ces récepteurs sont caractérisés par un très grand domaine extracellulaire (~ 600 acides aminés) ressemblant aux protéines périplasmiques bactériennes, impliquées dans le transport d’acides aminés de sucres et d’ions.

















































