Réaction d'oxydo-réduction - Définition
La liste des auteurs de cet article est disponible ici.
Équilibre des équations de réaction
Une réaction d'oxydo-réduction doit être équilibrée pour assurer un décompte exact des électrons en jeu. Il y a parfois des réactions complexes qui nécessitent d'équilibrer les coefficients stoechiométriques des demi-équations. Il faut parfois ajouter des molécules ou des ions en solution (en fonction du milieu) pour équilibrer.
Par exemple pour la réaction entre le permanganate de potassium (couple MnO4-/Mn2+) et une solution de fer (couple Fe3+/Fe2+) :
- (Fe2+ = Fe3+ + e-)x5
- MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
- MnO4- + 8H+ + 5Fe2+ → Mn2+ + 4H2O + 5Fe3+
Équilibrer la réaction redox, c'est également combiner linéairement les demi-réactions (oxydation et réduction) de manière que le nombre d'électrons donnés soit exactement le nombre d'électrons acceptés : la réaction redox est un échange strict d'électrons (thermodynamiquement favorable).
Par exemple :
- Fe = Fe3+ + 3e- ;
- O2 + 4 e- → 2 O2-
Dans le cas présent, il s'agit de trouver le plus petit commun multiple de 3 et de 4, soit 12, de manière à avoir un bilan d'échange strict : il faut donc combiner 4 fois la première demi-réaction (le fer va fournir 12 électrons) avec 3 fois la seconde demi-réaction (le dioxygène va accepter 12 électrons), soit :
- 4 Fe + 3O2 → 4 Fe3+ + 6 O2-
C'est l'échange d'électrons qui constitue le phénomène redox.
Ensuite, il se produit une attraction électrostatique : les charges positives et les charges négatives s'attirent et se disposent de manière à former un cristal ionique neutre :
- 4 Fe3+ + 6 O2- → 2 Fe2O3
Ceci n'est pas une réaction chimique à proprement parler, mais une réécriture correspondant à l'attraction statique dans le cristal ionique (une hématite).
Vocabulaire
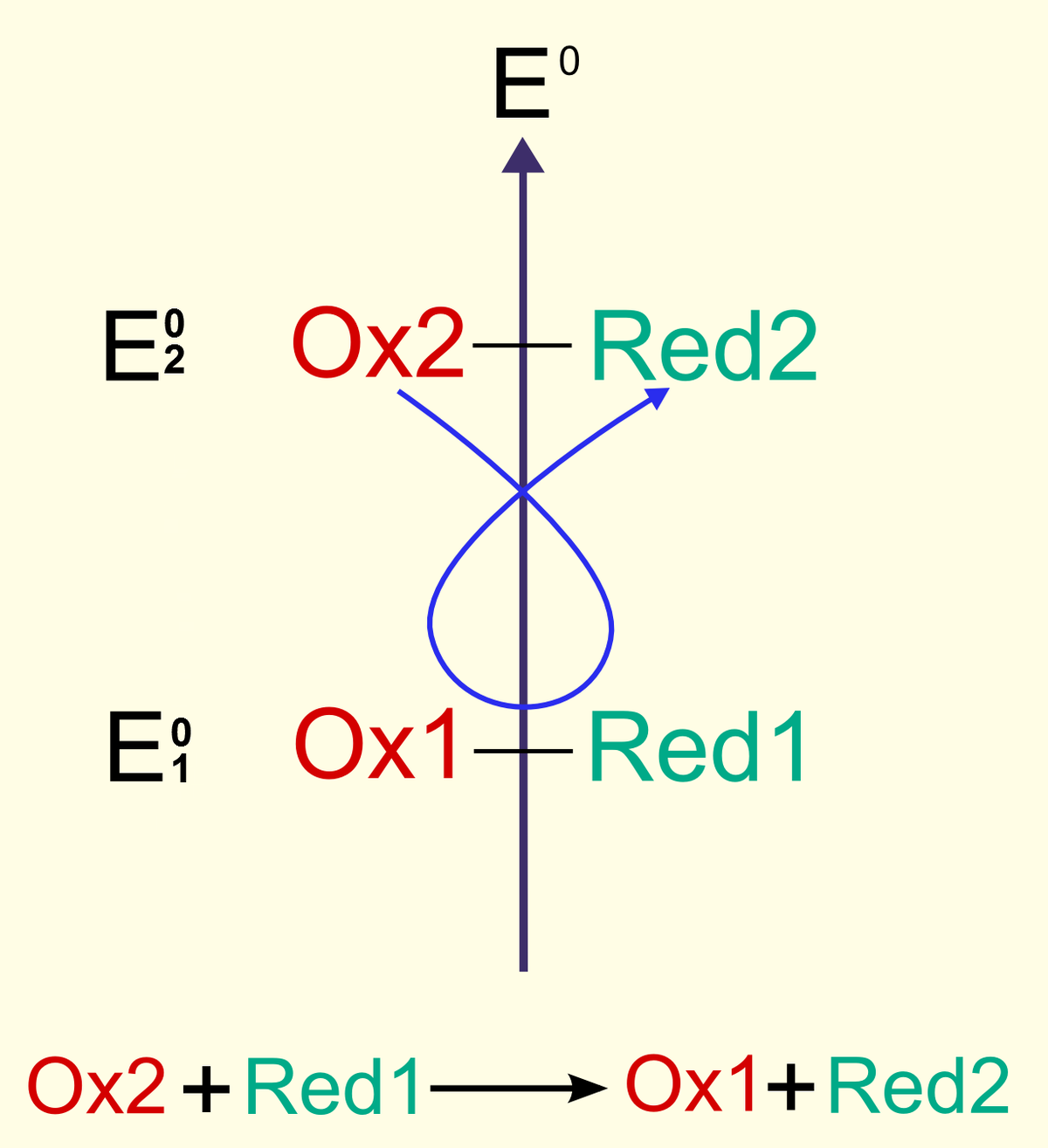
Dans une oxydo-réduction,
- l'élément qui perd un ou des électron(s) est appelé « réducteur »,
- l'élément qui capte un ou des électron(s) est appelé « oxydant ».
Le réducteur s'oxyde (réaction d'oxydation), l'oxydant se réduit (réaction de réduction). L'oxydo-réduction se compose donc de deux demi-réactions : une oxydation et une réduction.
- Oxydation
réducteur(1) = oxydant(1) + ne- (les flèches n'apparaissent que si la réaction est totale, quand K > 10 000) - Réduction
oxydant(2) + ne- = réducteur(2) - Oxydo-réduction (« somme » de l'oxydation et de la réduction)
oxydant(2) + réducteur(1) → oxydant(1) + réducteur(2)
Exemple :
- Ce4+ + e- = Ce3+
- Fe2+ = Fe3+ + e-
- d'où la réaction bilan :
- Ce4+ + Fe2+ → Ce3+ + Fe3+
Un réducteur oxydé (=forme oxydée) est un oxydant, et un oxydant réduit (=forme réduite) est un réducteur. On définit ainsi le couple oxydant-réducteur (aussi appelé « couple redox ») qui se compose de l'oxydant et du réducteur conjugué (l'oxydant réduit). On le note sous la forme : oxydant/réducteur.
En biochimie, et notamment à propos de la synthèse des molécules prébiotiques, on parle de réactions se produisant dans une atmosphère oxydante, c'est-à-dire en présence d'oxygène, par opposition à une atmosphère réductrice, contenant par exemple du gaz carbonique.
Certain composés chimiques peuvent se comporter aussi bien en oxydant qu'en réducteur. C'est notamment le cas de l'eau oxygénée, dont on dit qu'elle se dismute, et qui par conséquent ne peut être conservée longtemps :
- H2O2 = 2H+ + O2 + 2e- (oxydation)
- H2O2 + 2H+ + 2e- = 2H2O (réduction)
Soit au final :
- 2H2O2 → 2H2O + O2 (oxydo-réduction)
On a par exemple les couples oxydant-réducteur Cu2+/Cu et Zn2+/Zn, qui donnent la réaction en solution aqueuse :
- Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) (oxydo-réduction)
Cette réaction peut se décomposer en une réduction et une oxydation :
- Zn(s) = Zn2+(aq) + 2e- (oxydation)
- Cu2+(aq) + 2e- = Cu(s) (réduction)
Les deux demi-réactions d'oxydation et de réduction peuvent réellement être séparées dans certains cas (c'est-à-dire qu'elles ne se produisent pas au même endroit), ce qui permet de générer un courant électrique (c'est ce qui se passe dans les piles électriques). Dans les autres cas, par exemple dans l'exemple donné, elles n'ont qu'un intérêt formel (les électrons libres n'existent pas dans l'eau).

















































