Protéine recombinante - Définition
La liste des auteurs de cet article est disponible ici.
Construction du transgène
[3];[12];[14];[16]
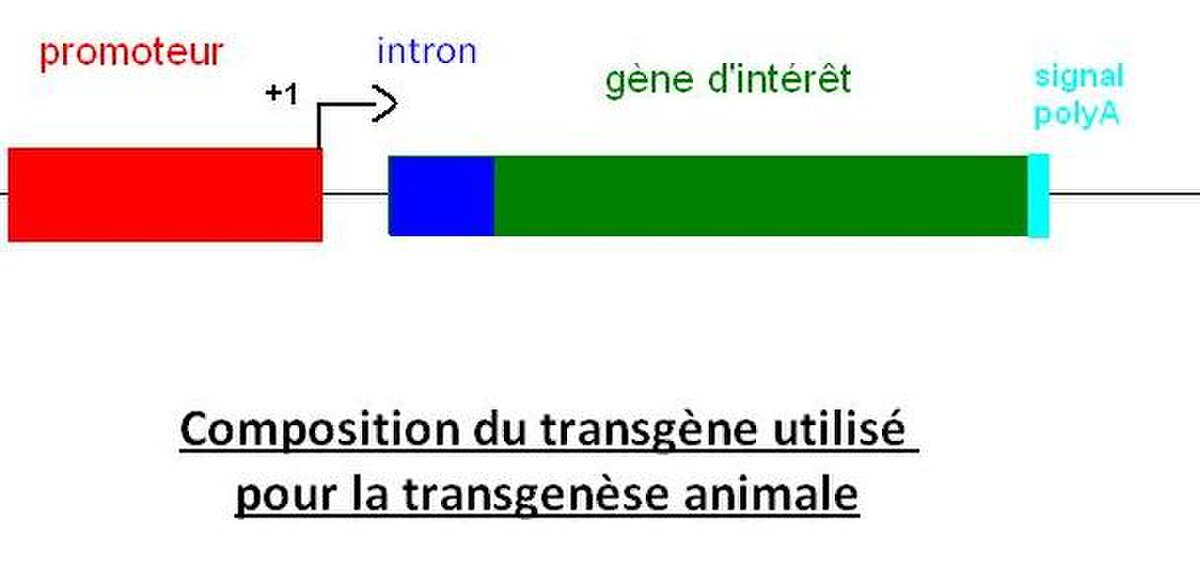
A.Composition du transgène
- Le vecteur est un moyen de transport de l’ADN. C’est un fragment capable de réplication autonome et qui peut supporter l’insertion d’un autre fragment d’ADN de taille variable (plasmide bactérien).
- L’organisme donneur exprime la protéine d’intérêt. L’ARNm codant cette protéine est isolé de cet organisme. L’ARNm permet la synthèse de l’ADNc qui sera utilisé pour le clonage. En effet, l’ADN génomique eucaryote n’est pas utilisable dans un système bactérien car les bactéries ne possèdent pas la machinerie d’épissage des ARNm eucaryotes.
C’est pourquoi la technique RT-PCR est souvent utilisée pour l’obtention de l’ADNc codant le gène d’intérêt. Suite à la réverse transcription des ARNm totaux en ARNm, l’ADNc correspondant à l’ARNm codant la protéine d’intérêt est amplifié par PCR en utilisant des amorces spécifiques auxquels sont ajoutés des sites de restrictions qui seront ensuite utilisés pour le clonage.
- Séquences régulatrices
Une fois l’ADNc d’intérêt amplifié, il lui faut ajouter les séquences permettant de cibler le tissu de transcription ainsi que les signaux de terminaison de la transcription et de la traduction. Ces séquences sont souvent présentes sur le plasmide dans lequel est cloné le gène d’intérêt :
- En 5’ : un promoteur spécifique du tissu dans lequel l’expression est attendue, ainsi qu’un intron dans le cas ou la transgénèse est réalisée en modèle eucaryote.
- En 3’ : un codon stop ainsi qu’un signal de polyadénylation.
Avec les bactéries il n’y a pas besoin d’introns.
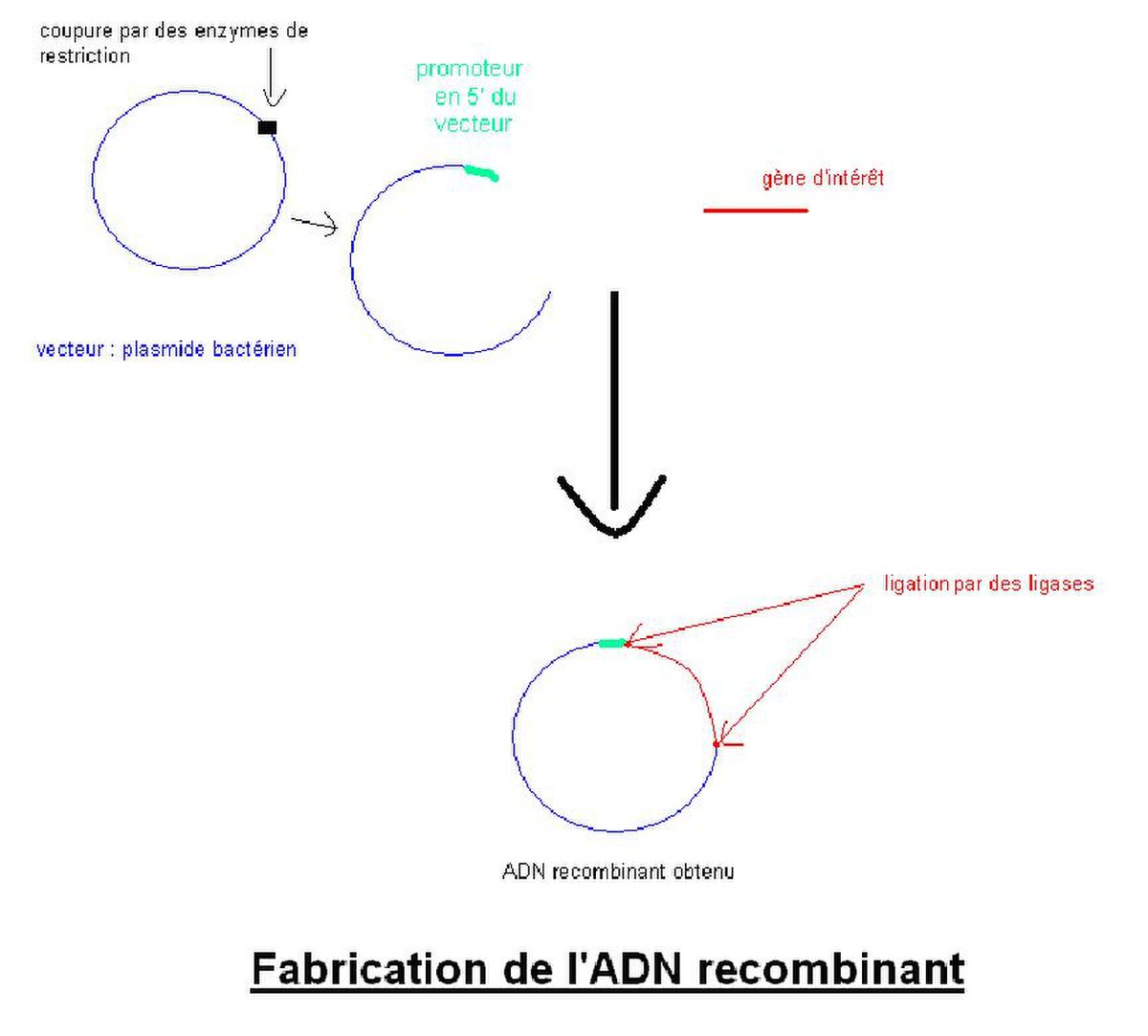
B.Clonage du gène d’intérêt
ADN recombinant :
L’ADNc amplifié par PCR est cloné dans un vecteur (BAC, YAC, plasmide bactérien…) contenant les séquences régulatrices décrites précédemment.
Pour cela, le vecteur (ici plasmide) ainsi que l’ADNc du gène d’intérêt sont digérés par des enzymes de restriction différentes afin d’orienter l’insertion de l’ADNc avant de liguer l’ADNc dans le plasmide à l’aide d’une ligase.
Le plasmide recombinant est ensuite introduit dans une bactérie, par transformation, afin d’amplifier le vecteur qui sera ensuite purifié. Avant de réaliser la transgénèse, le vecteur est linéarisé et les signaux de réplication bactériens ainsi que les gènes de résistances présents sur le plasmide sont éliminés par utilisation d’enzymes de restriction.
Bilbiographie
[2] Isabelle Collin cvc, Le génie génétique, « les animaux transgéniques », édition les Essentiels milans, 1999, pages 32-33
[3] Isabelle Collin cvc, Le génie génétique, « la technologie du clonage », édition les Essentiels milan, 1999, pages 18-19
[4] Académie des sciences, rst n° 14, février 2003, «protéines médicaments » Jean Hugues TROUVIN et Kowid HO, in De la transgénèse animale à la biothérapie chez l’homme, édition tec & doc, p116 à 139
[5] Académie des sciences, rst n° 14, février 2003, « transgénèse chez la souris » Charles BABINET, in De la transgénèse animale à la biothérapie chez l’homme, édition tec & doc, , p4 à 6 et p10
[6] Produire une protéine recombinante Principes et Méthodes de Biologie Moléculaire, Gabrielle Potocki-Veronese, INSA-Laboratoire Biotechnologie-Bioprocédés, Toulouse, Equipe Ingénierie Enzymatique Moléculairehttp://www.inra.fr/gdr-biopolymeres/pointpdf/pdfversailles/produireproteinerecombinante.pdf visité le 07/04/2010
[7] « Les protéines recombinantes issues du lait de chèvres clonées », http://www.agribionet.org/client/page1.asp?page=1945&clef=19&clef2=11 , visité le 25/05/2010
[8] « Antithrombine III », Dr Marie-Françoise Odou, http://www.doctissimo.fr/html/sante/analyses/sa_723_thrombineIII.htm visité le 26/05/2010
[9] « Le premier médicament OGM autorisé en Europe », Le figarohttp://www.lefigaro.fr/sciences/20061011.FIG000000056_le_premier_medicament_ogm_autorise_en_europe.html , visité le 26/05/2010.
[10] « Animal transgénique », in wikipédia, http://fr.wikipedia.org/wiki/Animal_transg%C3%A9nique visité le 9/05/2010
[11] « Historique sur le génie génétique », http://svtr.blogg.org/date-2008-02-04-billet-751843.html visité le 07/04/2010
[12] « Systèmes de production de protéines recombinantes », http://admi.net/evariste/100tc/1996/f018.html visité le30/04/2010
[13] Protéines recombinantes en système hétérologue,http://www.univ-bpclermont.fr/FORMATIONS/Licence/chimie/UE/36BIOF22/III)%20Proteines%20recombinantes.pdf visité le 12/04/2010
[14] « Protéines recombinantes et applications », PETRES Stéphane , BARA JAcques , GODEAU François http://www.canal-u.tv/producteurs/biotv/dossier_programmes/biotechnologies/proteines_recombinantes_et_applications, regardée le 22/04/2010
[15] “ATryn® - RECOMBINANT HUMAN ANTITHROMBIN”, ATryn® Press Release Archive, http://www.gtc-bio.com/products/atryn.html. Visité le 3/05/2010
[16] James WATSON, Tania BAKER, Stephen BELL, Alexander GANN, Michael LEVINE, Richard LOSICK, Biologie moléculaire du gene, edition Pearson Education France, 6ème édition, 2009
[17] http://www.inspection.gc.ca/francais/sci/ahra/bioanima/appf.shtml , visité le 22/04/2010