Protéasome - Définition
La liste des auteurs de cet article est disponible ici.
Ubiquitination
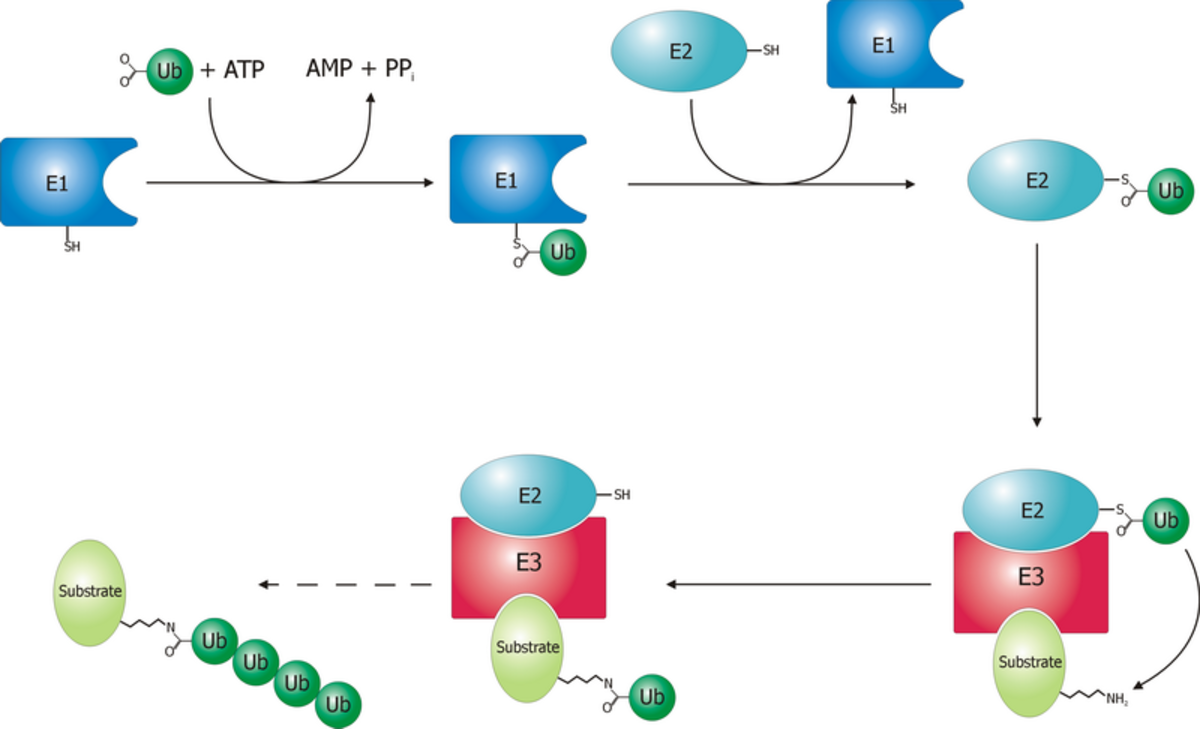
L’ubiquitine est une protéine de 76 acides aminés hautement conservée chez les Eucaryotes. Elle sert de signal de reconnaissance pour la dégradation par le protéasome 26S. Elle est fixée à la protéine à détruire par une liaison covalente entre l’un des résidus glycine de sa partie C-terminale et un groupement NH2 d’une lysine de la protéine ciblée. D’autres ubiquitines peuvent alors se fixer à un résidu lysine de la première ubiquitine pour former une chaîne. En effet, seules les protéines liées à une chaîne d’au moins quatre molécules d’ubiquitine sont reconnues par le protéasome 26S.
Ces opérations sont réalisés avec l’aide de trois autres types d’enzymes (notées E1,E2 et E3):
- L’enzyme d’activation de l’ubiquitine (E1), active l’ubiquitine en présence d’ATP en formant une liaison thiolester entre un résidu cystéine de son site catalytique et l’ubiquitine, puis transfère l’ubiquitine activée sur l’une des E2s.
- L’enzyme de conjugaison de l’ubiquitine(E2), modifie une fois de plus l’ubiquitine en formant une liaison thiolester et est capable d’attacher l’ubiquitine à la protéine cible en général avec l’aide d’une E3.
- L’ubiquitine ligase (E3), joue un rôle dans la reconnaissance entre l’ubiquitine et les différentes protéines cibles.
Un des domaines de l’ubiquitine reconnaît alors le complexe 19S du protéasome. Après avoir été enlevée par le protéasome, la chaîne de polyubiquitine est découpée pour être réutilisée. La monoubiquitination des protéines est également impliquée dans d’autres processus dont l’endocytose et l’exocytose.