Produit de solubilité - Définition
La liste des auteurs de cet article est disponible ici.
Produit de solubilité dans l'eau à 25 °C : exemples de valeurs numériques
Par ordre de solubilité décroissante
| Formule | Nom | Ks |
|---|---|---|
| NaCl | Chlorure de sodium | 38,98 |
| NiCO3 | Carbonate de Nickel | 1,3 . 10 -7 |
| TiBrO3 | Bromate de titane | 1,7 . 10-4 |
| CaC2O4 | Oxalate de calcium | 2 . 10-9 |
| PbCl2 | Chlorure de Plomb | 1,6 . 10 -5 |
| MnS | Sulfure de manganèse | 2,5 . 10-13 |
| Ca(OH)2 | Hydroxyde de calcium | 5,5 . 10-6 |
| Cu(OH)2 | Hydroxyde de cuivre | 2,2 . 10-20 |
| TiBr | Bromure de titane | 3,4 . 10-6 |
| HgS | Sulfure de mercure | 4 . 10-53 |
La valeur du produit de solubilité dépend de la température. En général, elle croît avec la température.
Le produit de solubilité est un nombre sans dimension, il n'a donc pas d'unité. Non, le produit de solubilité n'est pas un produit de concentrations, mais un produit de valeurs numériques (en mol/L) de concentrations. Il s'agit d'une constante thermodynamique intervenant dans la Loi d'action de masse.
Effet d’ion commun
Quel est le comportement d’un composé que l’on dissout dans une solution qui contient un ion de ce composé ?
Soit par exemple la dissolution du chlorure d’argent dans une solution d’ acide chlorhydrique de concentration molaire 0,1 M. L’acide chlorhydrique étant un acide fort se dissocie complètement en cations H+ et anions Cl-. Le chlorure d’argent se dissocie suivant la réaction :

De manière qualitative en utilisant le principe de Le Chatelier, on montre que l’augmentation d’ion chlorure (donc à droite de l’équilibre) provoque un déplacement de l’équilibre vers la gauche. La présence d’ion chlorure diminue la solubilité du chlorure d’argent.
Exemple :
Dans l’eau pure la solubilité du chlorure d’argent est :
|
| |||
| Espèce chimique | AgCl | Ag+ | Cl- |
|---|---|---|---|
| t=0 | s | 0 | 0 |
| Équilibre | 0 | s | s |
![K_s = \left[ Ag^+ \right] . \left[ Cl^- \right]](https://static.techno-science.net/illustration/Definitions/autres/c/cc1a145150e470a2d1e7846ec3062a99_d77432603382e6b618a4829f3838703e.png)
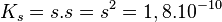
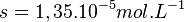
Si l’on dissout du chlorure d’argent dans la solution d’acide chlorhydrique 0,1 M la situation est la suivante :
|
| |||
| Espèce chimique | AgCl | Ag+ | Cl- |
|---|---|---|---|
| t=0 | s’ | 0 | 0,1 |
| Équilibre | 0 | s’ | s’+0,1 |
![K_s = \left[ Ag^+ \right] . \left[ Cl^- \right]](https://static.techno-science.net/illustration/Definitions/autres/c/cc1a145150e470a2d1e7846ec3062a99_d77432603382e6b618a4829f3838703e.png)
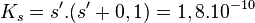
On peut faire l’hypothèse que s est très faible devant 0,1. On peut alors écrire :
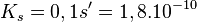
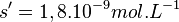
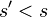
La solubilité du chlorure d'argent dans une solution d'acide chlorhydrique est inférieure à sa solubilité dans l'eau pure.
Vérification de l’hypothèse de calcul :
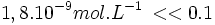
| |



















































