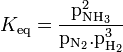Procédé Haber - Définition
La liste des auteurs de cet article est disponible ici.
Production annuelle
Au XXIe siècle, la production d'ammoniac synthétique consomme de 3 à 5% de la production mondiale de gaz naturel (entre 1 et 2% environ de la production mondiale d'énergie).
d'ammoniac synthétique
| Année | Production (milliers de tonnes métriques) | Prix moyen de la tonne aux États-Unis (USD) |
|---|---|---|
| 1994 | 92 000 | 211 |
| 1995 | 96 000 | 230 |
| 1996 | 96 000 | 225 |
| 1997 | 96 000 | 192 |
| 1998 | 106 000 | 121 |
| 1999 | 101 000 | 110 |
| 2000 | 109 000 | 169 |
| 2001 | 105 000 | 150 |
| 2002 | 109 000 | 137 |
| 2003 | 108 000 | 240 |
| 2004 | 117 000 | 274 |
| 2005 | 115 000 | 295 |
| 2006 | 124 000 | 201 |
| 2007 | 125 000 | 200 |
| 2008 | 136 000 | 500 |
Pour l'année 2000 ou 2001, Smil affirme que la production annuelle d'ammoniac aurait été d'environ 130 millions de tonnes, dont les 4/5 auraient été transformés en engrais azotés. Pour l'année 2002, Modak affirme que le procédé Haber-Bosch aurait permis la production annuelle de 130 millions de tonnes d'engrais azotés, la plupart sous la forme de sulfate d'ammonium, de phosphate d'ammonium ((NH4)3PO4), de nitrate d'ammonium et d'urée. Selon Lawrence, en 2002, 90 millions de tonnes d'engrais azotés, fabriqués à partir d'ammoniac synthétique, auraient été consommés.
Selon Smil, les productions de l'ammoniac et de l'acide sulfurique sont les deux plus importantes par la masse vers la fin des années 1990. Selon Modak, la production de l'ammoniac est la sixième plus importante par la masse en 2002.
Description
Le procédé Haber-Bosch consiste à favoriser la réaction exothermique de l'équation chimique à l'équilibre :
- N2(g) + 3 H2(g) ⇌ 2 NH3(g) + ΔH
En génie chimique, cette réaction est réalisée en plusieurs étapes :
- reformages (en amont du réacteur chimique) :
- purifier le dihydrogène ;
- éliminer les poisons catalytiques.
- synthèse (dans le réacteur chimique) :
- introduire du dihydrogène pur (H2(g)) ;
- introduire du diazote (N2(g)) ;
- synthétiser de l'ammoniac (NH3(g)) à l'aide de catalyseur.
- extraction (en aval du réacteur chimique) :
- séparer l'ammoniac des autres molécules (N2(g) et H2(g)) par liquéfaction ;
- recycler les molécules restantes.
- recycler la chaleur produite.
Pour parvenir à effectuer ces étapes de façon économique, il faut que le système de production :
- fonctionne à des pressions de l'ordre de 200 atm ;
- fonctionne à des températures allant de 500 à 600 °C ;
- fasse circuler en permanence des gaz et des liquides sous haute pression ;
- recycle la chaleur produite.
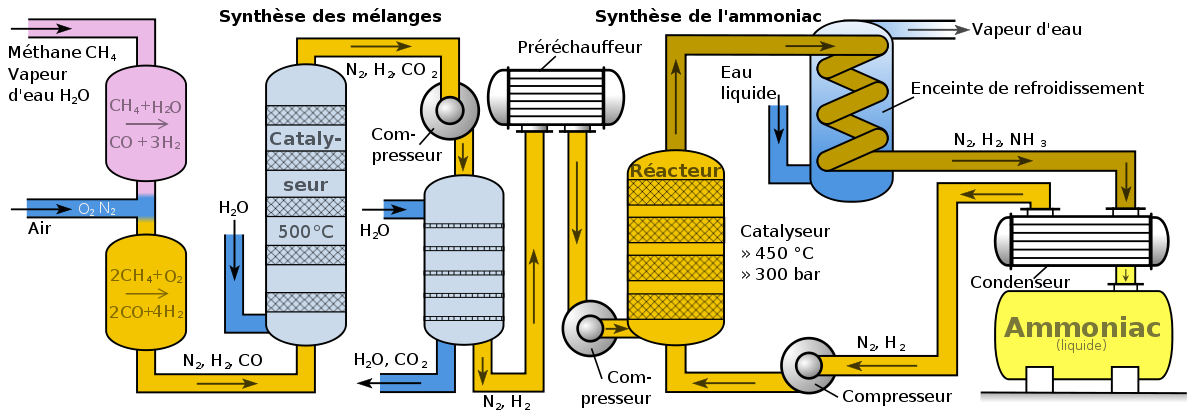
Reformages
Le méthane est purifié, surtout dans le but d'éliminer le soufre qui empoisonnerait les catalyseurs.
Le méthane purifié réagit ensuite avec de la vapeur d'eau lorsque mis en contact avec un catalyseur fait d'oxyde de nickel. C'est le processus de vaporéformage :
- CH4(g) + H2O(g) → CO(g) + 3 H2(g)
Un deuxième réformage suit en ajoutant de l'air dans le but de convertir le méthane qui n'a pas encore réagi pendant le vaporéformage :
- 2CH4 + O2 → 2 CO + 4 H2
- CH4 + 2 O2 → CO2 + 2 H2O
La réaction du gaz à l'eau permet d'obtenir plus d'hydrogène à partir du monoxyde de carbone et de la vapeur d'eau :
- CO + H2O → CO2 + H2
Le mélange gazeux passe alors dans un méthanateur, qui convertit la plupart du monoxyde de carbone restant en méthane :
- CO + 3 H2 → CH4 + H2O
Cette étape est nécessaire car le monoxyde de carbone empoisonne les catalyseurs.
À la fin de ces étapes, le méthane et une partie de la vapeur d'eau ont été transformés en dioxyde de carbone et en dihydrogène.
Synthèse de l'ammoniac
C'est pendant le procédé Haber proprement dit que survient la synthèse de l'ammoniac.
Le diazote et le dihydrogène réagissent sur un catalyseur de fer qui contient de l'hydroxyde de potassium comme accélérateur :
- N2(g) + 3 H2(g) ⇌ 2 NH3(g) + ΔH, ΔHo = -92,4 kJ/mol à 25 °C
Cette réaction, à l'équilibre, est effectuée à une pression se situant entre 15 et 25 MPa et à une température allant de 300 à 550 °C. Les réactifs gazeux circulent sur quatre lits de catalyseurs. À chaque passage, environ 15 % des réactifs sont transformés, mais tous les réactifs qui n'ont pas réagi sont recyclés, ce qui permet d'atteindre un taux de conversion de 98 %. Après chaque passage, les réactifs sont refroidis pour maintenir une constante d'équilibre raisonnable.
Le vaporéformage, la réaction du gaz à l'eau, l'élimination du dioxyde de carbone et la méthanation surviennent à des pressions absolues se situant entre 2,5 et 3,5 MPa.
En développant son procédé, Haber mis au point la technique du recyclage des réactifs inutilisés. Si les réactifs sont mis en présence une seule fois, les paramètres de l'équation chimique à l'équilibre ne donnent pas un taux de conversion suffisamment élevé. Haber se rendit compte qu'il était possible d'extraire une partie des produits, évacués à haute pression du réacteur chimique, et d'injecter de nouvelles quantités de réactifs dans le réacteur pour y maintenir une pression favorisant la production d'ammoniac. Au XXIe siècle, cette technique est aussi appliquée en chimie organique à haute pression.
Vitesse de réaction et constante d'équilibre
Pour effectuer la synthèse, il faut considérer deux paramètres contradictoires : la constante d'équilibre et la vitesse de réaction. À la température de la pièce, la réaction est lente et une solution évidente serait d'élever sa température. Cela peut augmenter la vitesse de réaction, mais puisque la réaction est exothermique, ce changement favorise, selon la loi expérimentale de Van't Hoff, la réaction inverse (endothermique). Cela réduit donc la constante d'équilibre qui se calcule par :
|
Quand la température augmente, l'équilibre se déplace et la constante d'équilibre diminue énormément selon la relation de Van't Hoff. Il faudrait donc imposer une basse température et recourir à d'autres moyens pour augmenter la vitesse de réaction. Cependant, le catalyseur exige une température d'au moins 400 °C pour être efficace.
Sachant que la constante d'équilibre peut être modifiée par la concentration, la température ou la pression, cette dernière est probablement le meilleur paramètre à manipuler pour favoriser la réaction directe. En effet, il y a 4 moles de réactifs pour 2 moles de produits. Selon le principe de Le Chatelier, une augmentation de la pression favorisera la réaction qui diminue la pression du système à l'équilibre.
Une pression d'environ 200 atm modifie suffisamment la constante d'équilibre pour obtenir une production raisonnable. Financièrement, par contre, la production de pression est une opération coûteuse. En effet, les spécifications des tuyaux, des récipients et des valves doivent être plus sévères que les normes habituelles. Le fonctionnement des pompes et des compresseurs à cette pression demande beaucoup d'énergie. Il y a aussi des considérations de sécurité à prendre en compte. Pour toutes ces raisons, un compromis doit être fait : à chaque passage des réactifs, le taux de conversion est d'environ 15 %.
Le taux de conversion de la réaction peut être augmenté en retirant des produits (le gaz d'ammoniac) du système. En pratique, ce gaz n'est pas retiré du réacteur même, puisque la température y est trop élevée, mais du mélange gazeux à l'équilibre qui sort du réacteur. Les gaz chauds sont suffisamment refroidis, même si la pression demeure élevée, pour que l'ammoniac puisse être liquéfié. L'hydrogène et l'azote qui n'ont pas réagi sont à nouveau ré-introduits dans le réacteur dans le but de les convertir en ammoniac.
Catalyseurs
Pour les besoins de cette industrie, le catalyseur à base de fer est préparé en exposant une masse de magnétite, un oxyde de fer, à un gaz de dihydrogène porté à haute température. Cela réduit une partie de la magnétite en fer métallique, éliminant l'oxygène dans le processus. Le volume initial du catalyseur est conservé en grande partie. La masse est devenue un matériau très poreux où sa grande surface de contact multiplie son efficacité catalytique. Le catalyseur inclut également du calcium et des oxydes d'aluminium, ce qui facilite l'activité catalytique et maintient la surface de contact tout au long de son existence, ainsi que du potassium, ce qui augmente la densité électronique du catalyseur et améliore son activité.
En présence du catalyseur, la réaction évoluerait comme suit :
- N2(g) → N2(adsorbé)
- N2(adsorbé) → 2 N(adsorbé)
- H2(g) → H2(adsorbé)
- H2(adsorbé) → 2 H(adsorbé)
- N(adsorbé) + 3H(adsorbé) → NH3(adsorbé)
- NH3(adsorbé) → NH3(g)
La réaction 5 survient en trois étapes, formant successivement NH, NH2 et NH3. Des indices, obtenus à partir de différentes expériences, montrent que la réaction 2 est la plus lente.
La compréhension de ces étapes est en grande partie due aux travaux de Gerhard Ertl.