Plutonium - Définition
La liste des auteurs de cet article est disponible ici.
Description
Propriétés physiques et chimiques
Le plutonium est un métal de la série des actinides. Son aspect est gris argenté, mais il se ternit rapidement à l'air libre, devenant généralement gris, parfois verdâtre ou jaunâtre. Il est relativement mou, très dense (densité : 19,84), solide à température ambiante mais à point de fusion relativement bas (640 °C) et à température d'ébullition exceptionnellement élevée (3 327 °C). Contrairement à la plupart des matériaux, sa densité s'accroît (de 2,5%) à la fusion, si bien qu'un lingot de plutonium flottera à la surface du métal en fusion. La densité du métal liquide décroît ensuite linéairement avec la température. Autour de sa température de fusion, le plutonium liquide présente une très forte viscosité et une tension superficielle élevée par comparaison avec d'autres métaux.
Contrairement à la plupart des métaux, c'est un mauvais conducteur de la chaleur et de l'électricité. Sa conductivité électrique décroît quand la température baisse, ce qui est très atypique pour un métal. Cette tendance se prolonge jusqu'à 100 K, puis la conductivité croît pour des échantillons récemment préparés. Aux alentours de 20 K, la résistivité croît avec le temps sous l'effet des radiations alpha, qui disloquent le réseau cristallin ; cet effet varie suivant la composition isotopique de l'échantillon.
Le mouvement des atomes sous l'effet de l'auto-irradiation du plutonium disloque progressivement sa structure cristalline par accumulation de défauts cristallins. Cependant, l'auto-irradiation peut également chauffer suffisamment l'échantillon pour conduire à un recuit, ce qui contrebalance l'effet précédent pour des températures supérieures à 100 K.
Métallurgie
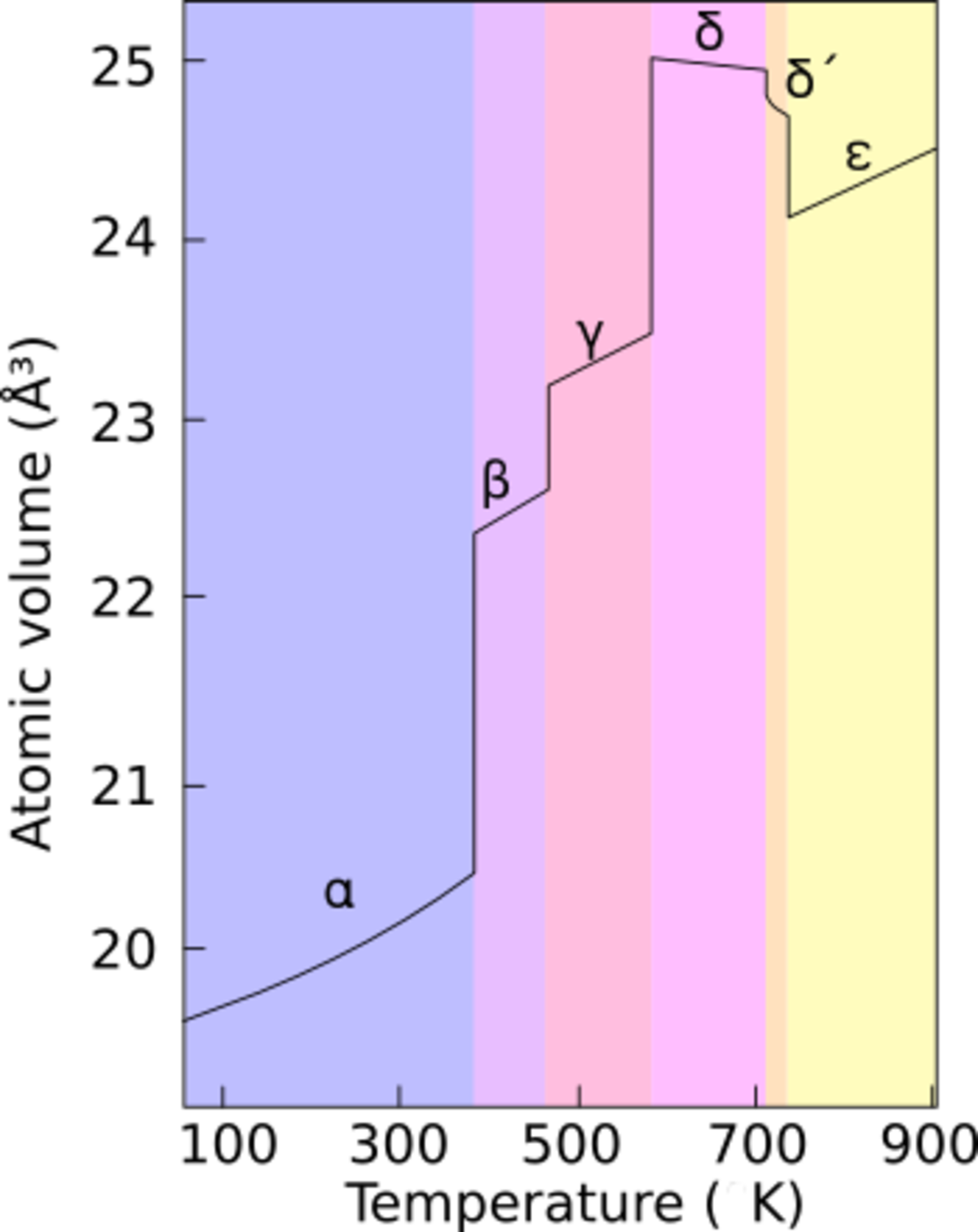
Le plutonium présente six états allotropiques dans les conditions normales de pression. Une septième forme (zeta, ζ) se rencontre à haute température, mais dans un intervalle de pression limité.
Ces allotropes ont des énergies internes très proches, mais des structures cristallines et des densités très différentes : les densités de ces formes allotropes varient de 16.00 g/cm3 à 19.86 g/cm3. Ceci rend le plutonium très sensible à des changements de température, de pression, ou de pollution chimique, et la transition de phase d'un état à l'autre peut conduire à des changements de volume très importants.
L'existence de ces nombreux allotropes rend très difficile l'usinage du métal, parce que ses propriétés physiques changent très facilement. Par exemple, à température ambiante, il se trouve dans sa forme alpha : une structure monoclinique de faible symétrie, qui de ce fait est dure et cassante comme de la fonte grise, compressible, et d'une conductivité médiocre. Mais à une température légèrement supérieure, il passe en forme β, qui est au contraire malléable et plastique. Les raisons d'un comportement aussi complexe ne sont pas entièrement comprises.
Le plutonium pur se trouve dans sa forme δ entre 310 °C et 452 °C. Cependant, cette forme est stable à température ambiante quand le plutonium est allié avec une faible proportion de gallium, d'aluminium, ou de cérium, ce qui permet son usinage et son soudage. La phase delta, de type cubique à face centrée, présente de plus une forte anisotropie de son élasticité, qui peut varier d'un facteur six à sept suivant les directions. Les propriétés physiques de cette forme delta sont plus celles d'un métal classique, elle est à peu près aussi résistante et malléable que de l'aluminium. Sur le plan metallurgique, travailler en phase delta stabilisée permet d'éviter la contraction très importante du changement de phase au refroidissement, qui déformerait des pièces de fonderie en plutonium pur. De même, la stabilisation fait disparaître la transition de phase inverse, qui pourrait apparaître sur des pièces de plutonium pur à la suite d'un chauffage accidentel, entraînant des gonflements et des distortions de la pièce.
Dans les armes à fission, l'onde de choc qui comprime le noyau (au-delà de quelques dizaines de kilobars) provoque également une transition de la phase delta vers la forme alpha, nettement plus dense, ce qui permet d'atteindre plus facilement la criticité.
Propriétés chimiques
Le plutonium réagit avec l'oxygène, la vapeur d'eau et les acides, le carbone, les halogènes, l'azote et le silicium.
Exposé à de l'air humide, il forme des oxydes et des hydrures qui le font augmenter de volume de près de 70%, ce qui disloque et pulvérise sa surface, et peut le conduire à des combustions spontanées.
Il ne réagit pas avec les bases.
Il présente quatre états d'oxydation principaux.
Dioxyde de plutonium
Le dioxyde de plutonium PuO2 est, pour les radiochimistes, la forme la plus pratique pour manipuler le plutonium. Découvert en 1940 par les chimistes américains partis sur le chemin de la bombe atomique, on le retrouve pour le recyclage des combustibles nucléaires, la confection des ogives ou le stockage des déchets radioactifs. Il s'agit d'une poudre de cristaux jaunes-verts.
Il a longtemps été considéré comme inoxydable.
En France, le dioxyde de plutonium est stocké en surface, dans des boites étanches, pour être ensuite réutilisé dans des centrales ordinaires, en entrant dans la composition du combustible MOX (Mixed OXyde).
Propriétés radiologiques
Le plutonium est un métal très radioactif (selon la composition isotopique, les isotopes 238 et 241 étant de très loin les plus radioactifs).
Il se désintègre principalement par radioactivité α, avec une intensité suffisante pour produire une chaleur sensible : avec une demi-vie de 24000 ans pour le 239>Pu dit « de qualité militaire », un coeur typique d'arme nucléaire de 5 kg contient 12.5 × 1024 atomes et se désintègre au rythme de 11.5 × 1012 désintégrations par secondes (becquerels) en émettant des particules alpha de 11.5 × 1012 en moyenne ; ce qui correspond globalement à une puissance de 9,68 watts.
Il y a 15 isotopes connus. Les isotopes les plus produits en réacteurs sont les isotopes 238, 239, 240, 241, 242. Tous sont radioactifs. Les isotopes de numéro atomique impair (239 et 241) sont fissiles en spectre thermique (réacteurs actuellement en production). La période de demi-vie pour l'isotope 239 est de 24 000 ans.



















































