Phosphate - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Phosphate | |
|---|---|
| |
| Général | |
| No CAS | |
| PubChem | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | PO43− |
| Masse molaire | 94,9714 ± 0,0012 g·mol-1 |
| | |

Un phosphate, en chimie inorganique, est un sel d'acide phosphorique résultant de l'attaque d'une base par de l'acide phosphorique.
En chimie organique, c'est un composé organophosphoré dérivé de l'acide phosphorique ; on parle parfois de phosphate organique.
Dosage du phosphate
La mesure de la concentration de phosphate est basée sur l’apparition de phosphomolybdate d’ammonium qui est détecté par photométrie dans l’ultraviolet. les ions chlorures peuvent gêner et doivent être éliminés en faisant bouillir avec deux gouttes d'acide nitrique, l'addition au réactif molybdique de tartrate améliore la spécificité.
On fera réagir le réactif molybdique: ce réactif est une solution de molybdate d' ammonium (NH4)2MoO4, dans de l'acide nitrique 6M, qui donne à chaud, avec un phosphate, un précipité jaune de phosphomolybdate d'ammonium (NH4)3PO4(MoO3)2.
Expérience: Verser 1 mL de solution de phosphate dans un tube à essais. Ajouter 10 gouttes d' acide nitrique 15M. Dans un autre tube verser 1 mL de réactif molybdique. Faire tiédir le réactif et ajouter quelques gouttes de la solution acidifiée contenant le phosphate. Constater la précipitation du phosphomolybdate d' ammonium.
Les ions argent pour le phosphate donne un précipité jaunatre Ag3PO4
L'hydrogénophosphate de sodium donne avec l'ion Ag +un précipité jaune de phosphate d'argent soluble dans l'acide nitrique et dans l'ammoniac.
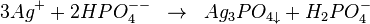
Formation et répartition
Le minerai de phosphate (roche concentrée en sels de phosphate) est une roche sédimentaire dite exogène : elle se forme par concentration lorsque des ions phosphate précipitent dans une roche en diagenèse. Les formes biogènes, telles les guanos d'oiseaux et de chauve-souris, sont exploitées depuis des siècles.
Les gisements les plus importants se trouvent au Maroc, en Amérique du Nord, sur Navassa, en Tunisie, au Togo, en Israël, en Jordanie, en Chine et sur certaines îles d'Océanie : Nauru, Banaba et Makatea.
Caractéristiques moléculaires et chimiques
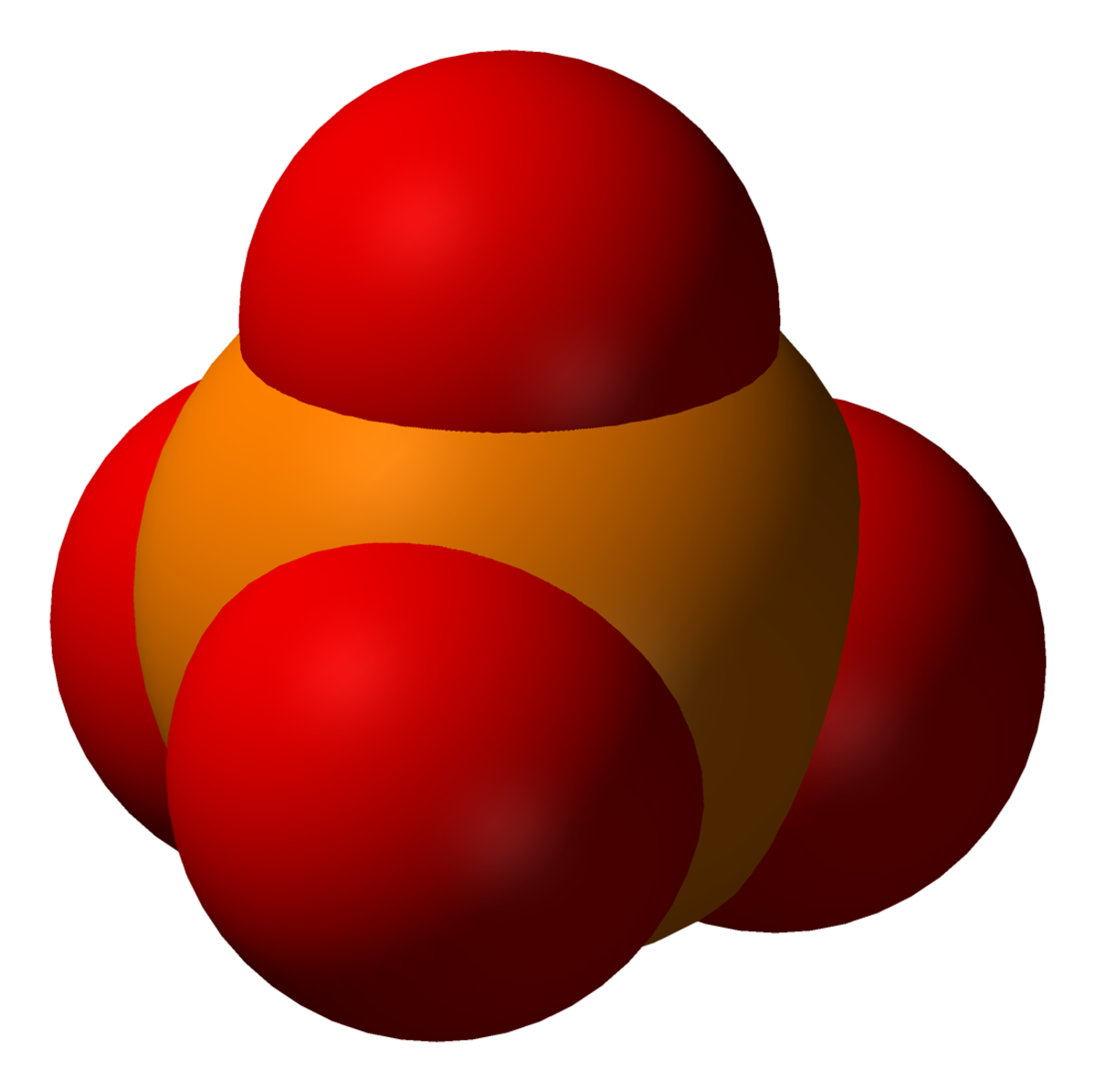
L’ion phosphate (ou orthophosphate) est un anion polyatomique de formule chimique brute PO43- et de masse moléculaire de 94,97 daltons. Il se présente sous la forme d'un tétraèdre dont les sommets sont formés par les quatre atomes d'oxygène encadrant un atome de phosphore.
Cet ion, qui comporte trois charges négatives, est la base conjuguée de l'ion hydrogénophosphate HPO42- (ou phosphate inorganique, noté Pi) qui est lui-même la base conjuguée de l'ion dihydrogénophosphate H2PO4- qui est lui-même la base conjuguée de l'acide phosphorique H3PO4. C'est une molécule hypervalente sachant que l'atome de phosphore possède dix électrons libres sur sa couche de valence.
Un sel de phosphate se forme lorsqu'un cation se lie à l'un des atomes d'oxygène de l'ion phosphate, formant un composé ionique. La plupart des phosphates sont insolubles dans l'eau aux conditions standard de température et de pression excepté pour les sels de métaux alcalins.
Solubilisé dans une solution aqueuse, le phosphate existe sous ses quatre formes selon le taux d’acidité. En allant du plus basique au plus acide :
- la première forme à prédominer est l‘ion phosphate (proprement dit) PO43- (fortement basique),
- la seconde forme est l’ion hydrogénophosphate HPO42- (faiblement basique),
- la troisième forme est l’ion dihydrogénophosphate H2PO4- (faiblement basique) et enfin
- la quatrième est la forme trihydrogénophosphate (à l’état cristallin non ionisé) ou acide phosphorique H3PO4 (fortement acide en solution).
L’ion phosphate peut former des ions polymériques comme :
- le diphosphate P2O74− (aussi appelé pyrophosphate),
- le triphosphate P3O105−, etc.
Les phosphates formant des complexes avec le calcium (contrôle micro-environnemental pendant la (bio-)minéralisation), ils entrent souvent dans la composition des lessives. Riche en phosphore, les rejets lessiviels augmentent donc le risque d'eutrophisation. Depuis les années 1980, les fabricants utilisent donc de plus en plus des substituts, telles les zéolites.