Paracétamol - Définition
La liste des auteurs de cet article est disponible ici.
Chimie
Structure et réactivité
Dans les conditions ordinaires, le paracétamol est une poudre blanche avec un léger goût, soluble dans 70 volumes d'eau, 7 volumes d'alcool à 95 %, 13 volumes d'acétone, 40 volumes de glycérol ou 50 volumes de chloroforme. Cependant, il est insoluble dans l'éther et le benzène. Le paracétamol est stable dans l'eau, mais sa stabilité diminue en milieu acide ou basique. Les mélanges de paracétamol sont stables dans des conditions humides. Cependant, les comprimés qui contiennent de la codéine ou du stéarate de magnésium se dégradent en diacétyl-p-aminophénol dans une atmosphère humide.
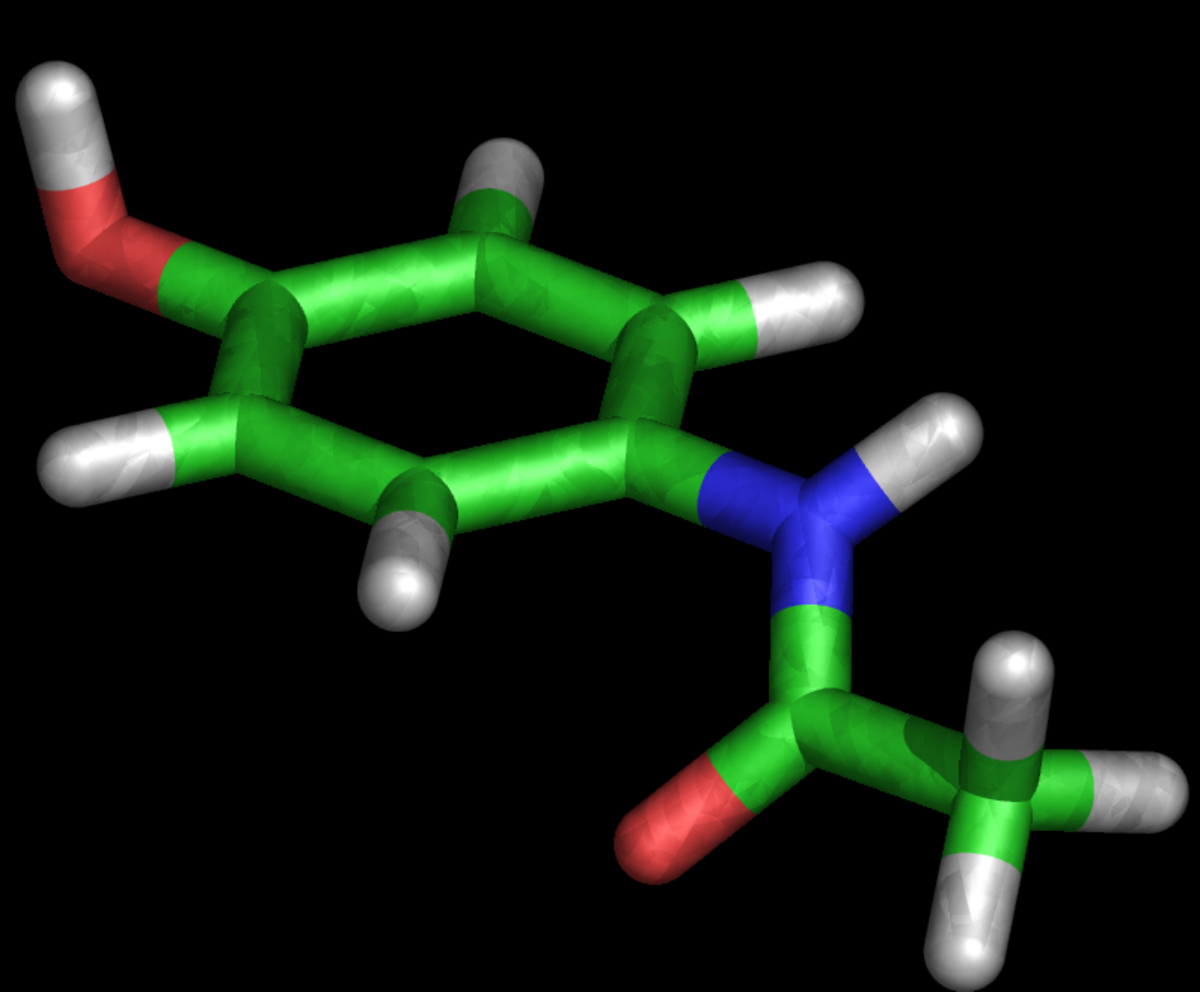
La molécule est constituée d'un cycle benzénique, substitué par un groupement hydroxyle et par un groupement amide en position para. Le paracétamol ne comporte pas de carbone asymétrique et n'a pas de stéréoisomère. Un des deux doublets libres de l'atome d'oxygène du groupement hydroxyle, le cycle benzénique, le doublet libre de l'atome d'azote et l'orbitale p du carbone du carbonyle forment un système conjugué. Cette conjugaison réduit la basicité des oxygènes et de l'azote et rend le groupement hydroxyle plus acide (comme les phénols) car la délocalisation des charges s'effectue sur un ion phénolate.
La présence de deux groupements activants rend le cycle hautement réactif pour une substitution électrophile aromatique, les substituants étant ortho et para directeurs. Toutes les positions du cycle sont plus ou moins activées de la même manière et il n'y a donc pas de site privilégié dans le cas d'une substitution électrophile. Le paracétamol est le métabolite actif de l'acétanilide et de la phénacétine : le paracétamol est produit par la décomposition de ces deux produits dans l'organisme. Ces espèces chimiques sont de la même famille chimique et ont une structure chimique très proche.
Synthèse
Le paracétamol ne comprend pas de centre chiral et n'a aucun stéréoisomère. La synthèse n'a pas besoin d'être stéréocontrôlée et elle est plus simple que les synthèses asymétriques d'autres substances pharmaceutiques.
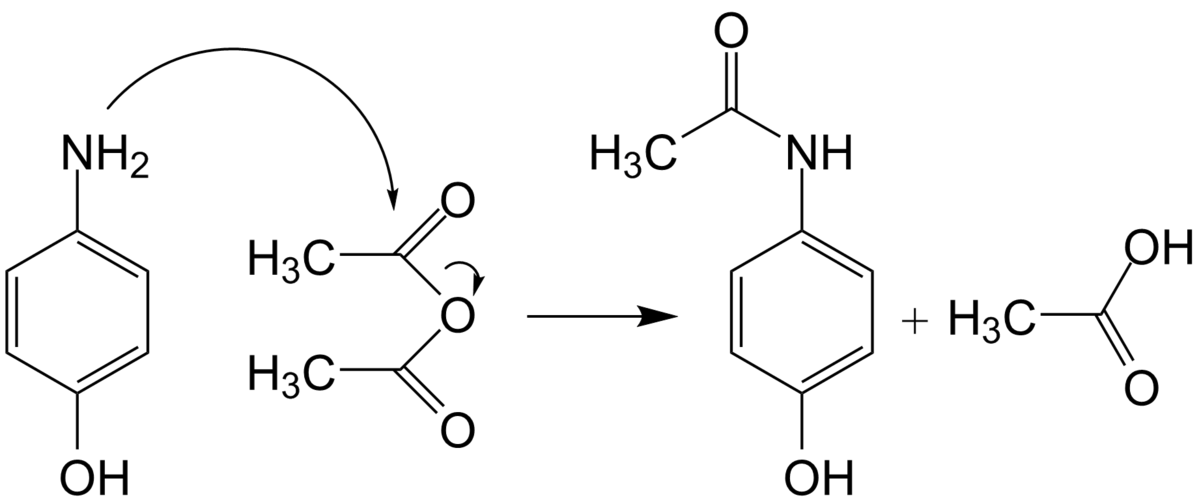
Le paracétamol fut synthétisé pour la première fois en 1878 par Harmon Northrop Morse. La première étape est la réduction du para-nitrophénol en para-aminophénol en présence d'étain dans de l'acide acétique glacial. Le para-aminophénol obtenu est ensuite acylé par l'acide acétique pour obtenir du paracétamol. Vignolo simplifia cette synthèse en utilisant le para-aminophénol comme produit de départ. Une seule étape d'acylation est nécessaire pour obtenir le produit désiré, ce qui raccourcit la synthèse. Plus tard, Friedlander modifia la synthèse en faisant l'acylation du para-aminophénol à partir de para-nitrophénol avec de l'anhydride acétique au lieu de l'acide acétique, ce qui donne un meilleur rendement.
Équation de la synthèse : C4H6O3 + C6H7NO → C8H9NO2 + CH3COOH
L'intérêt du paracétamol a été réduit lors des premières années de commercialisation en raison d'une contamination par le para-aminophénol à cause du procédé de fabrication. Cette impureté était, comme l'acétanilide, méthémoglobinisante.
De nos jours, il existe différentes méthodes de synthèse industrielle, la plupart utilisant l'acylation du para-aminophénol avec de l'anhydride acétique.
Autres dénominations
- acetaminophen (nom utilisé dans les pays anglo-saxons)
- acétyl paraminophénol, acétyl-p-amino-phénol, hydroxy-4' acétanilide, para-acétamidophénol, para-acétamino-phénol, N-acétyl-para-aminophénol.