Parabène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
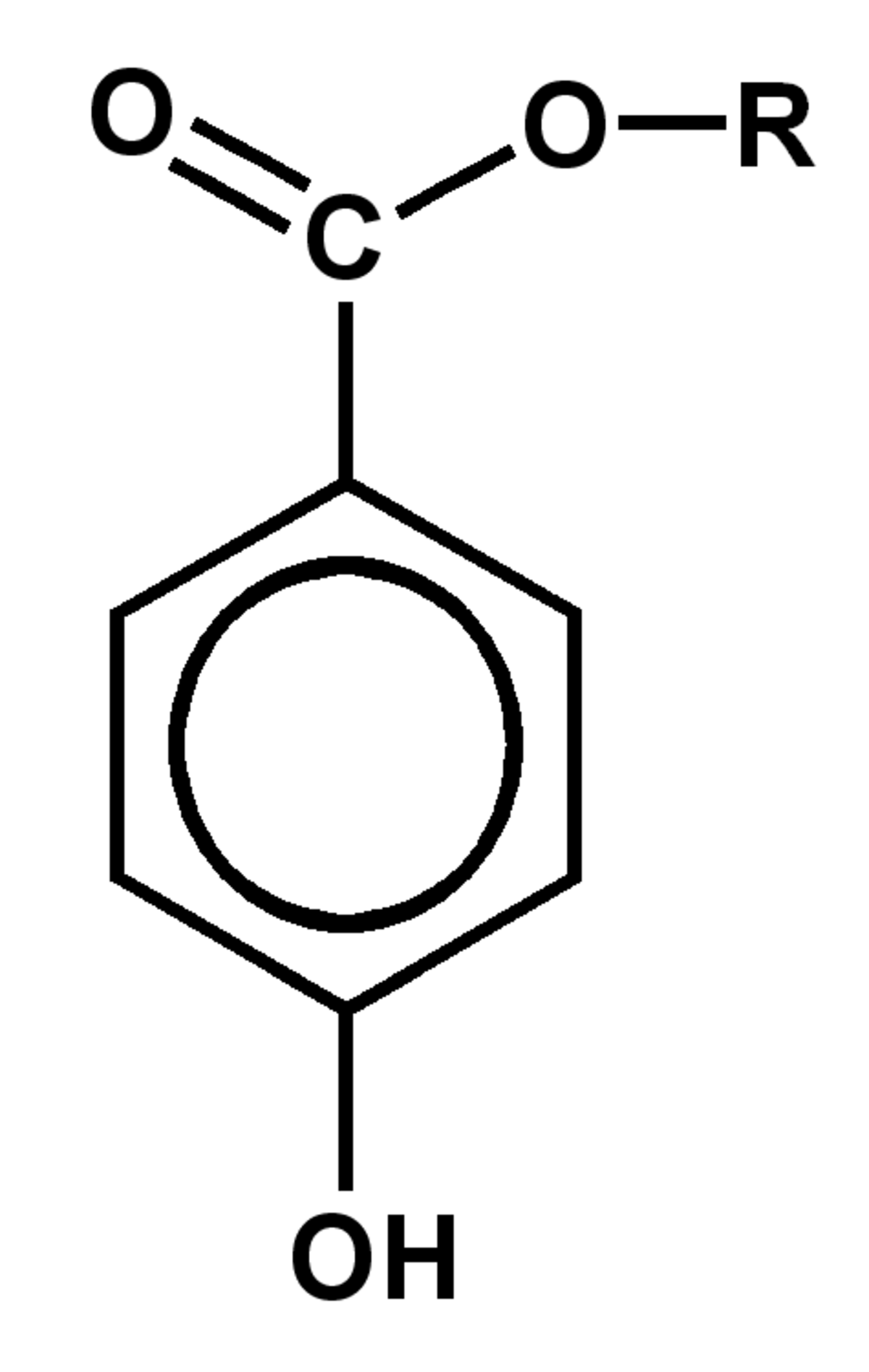
Un parabène est un parahydroxybenzoate d'alkyle, c'est-à-dire un ester résultant de la condensation de l'acide parahydroxybenzoïque avec un alcool.
La structure générale d'un parabène étant donnée par l'illustration ci-contre, les différents composés de cette famille diffèrent par la nature du groupe alkyle R .
Les parabènes sont très largement utilisés comme conservateurs dans les cosmétiques, les médicaments et les aliments, pour leurs propriétés antibactériennes et antifongiques.
Actuellement leur utilisation est largement controversée en raison de leur capacité à activer les récepteurs des œstrogènes, induisant une possible action sur la fertilité et les tumeurs œstrogéno-dépendantes (tels le cancer du sein).
Chimie
Les composés de la famille des parabènes les plus couramment utilisés sont :
- le méthylparabène ou 4-hydroxybenzoate de méthyle (E218) et son sel de sodium (E219)
- l'éthylparabène ou 4-hydroxybenzoate d'éthyle (E214) et son sel de sodium (E215)
- le propylparabène ou 4-hydroxybenzoate de propyle (E216) et son sel de sodium (E217)
- l'isopropylparabène
- le butylparabène
- l'isobutylparabène
- le benzylparabène
Utilisation
Du fait de leur activité effective antibactérienne et antimycosique, ils sont utilisés comme conservateurs dans des aliments, des boissons, des cosmétiques et des produits pharmaceutiques. On les retrouve dans plus de 80 % des produits de beauté dont des shampooings, des crèmes hydratantes, mousses à raser, gels nettoyant, lubrifiants...
L’activité antimicrobienne augmente en fonction de la longueur de la chaîne carbonée de l'alcool estérifié du parabène ; mais les plus utilisés sont le méthylparabène et le propylparabène du fait de leur plus grande solubilité et parce qu'ils possèdent un effet synergique.
Des additifs spécifiques comme le méthylparabène sont ajoutés aux anesthésiques locaux pour augmenter l’activité antibactérienne. Ils sont ajoutés pour limiter la contamination par l’entrée de différents vials.
Le méthylparabène est le conservateur le plus utilisé dans l’anesthésie locale. À l’état pur, il est incolore et n’est pas affecté par la chaleur ou le froid. Les solutions de méthylparabène sont stables à un pH entre 3 et 6, mais ils sont hydrolysés dans un environnement alcalin. Le propylparabène a des propriétés similaires. Ces conservateurs ne remplacent pas les techniques de stérilisation mais aident seulement à diminuer la charge microbiologique.
Le méthylparabène (poudre solide) est aussi utilisé comme plastifiant pour certains médicaments à cause de ses propriétés semi-conductrices. Il permet de contrôler le dégagement des médicaments à base de polymère et faciliter le processus thermique. Les plastifiants sont importants pour diminuer la température vitreuse (Tg) et ramollir les médicaments polymères durant son extrusion. Alors la Tg du polymère diminue en augmentant la quantité du méthylparabène, ceci est dû à l’augmentation de la mobilité de chaînes des molécules du polymère quand le méthylparabène est inséré dans la matrice. Tout cela se passe sous haute température.
Parabènes naturels
[réf. nécessaire]