Paludisme - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Classifications CIM du Paludisme Classification et ressources externes | ||
| CIM-10 | B50. | |
|---|---|---|
| CIM-9 | 084 | |
| OMIM | 248310 | |
| DiseasesDB | 7728 | |
| MedlinePlus | 000621 | |
| eMedicine | med/1385 emerg/305 ped/1357 | |
| MeSH | C03.752.250.552 | |
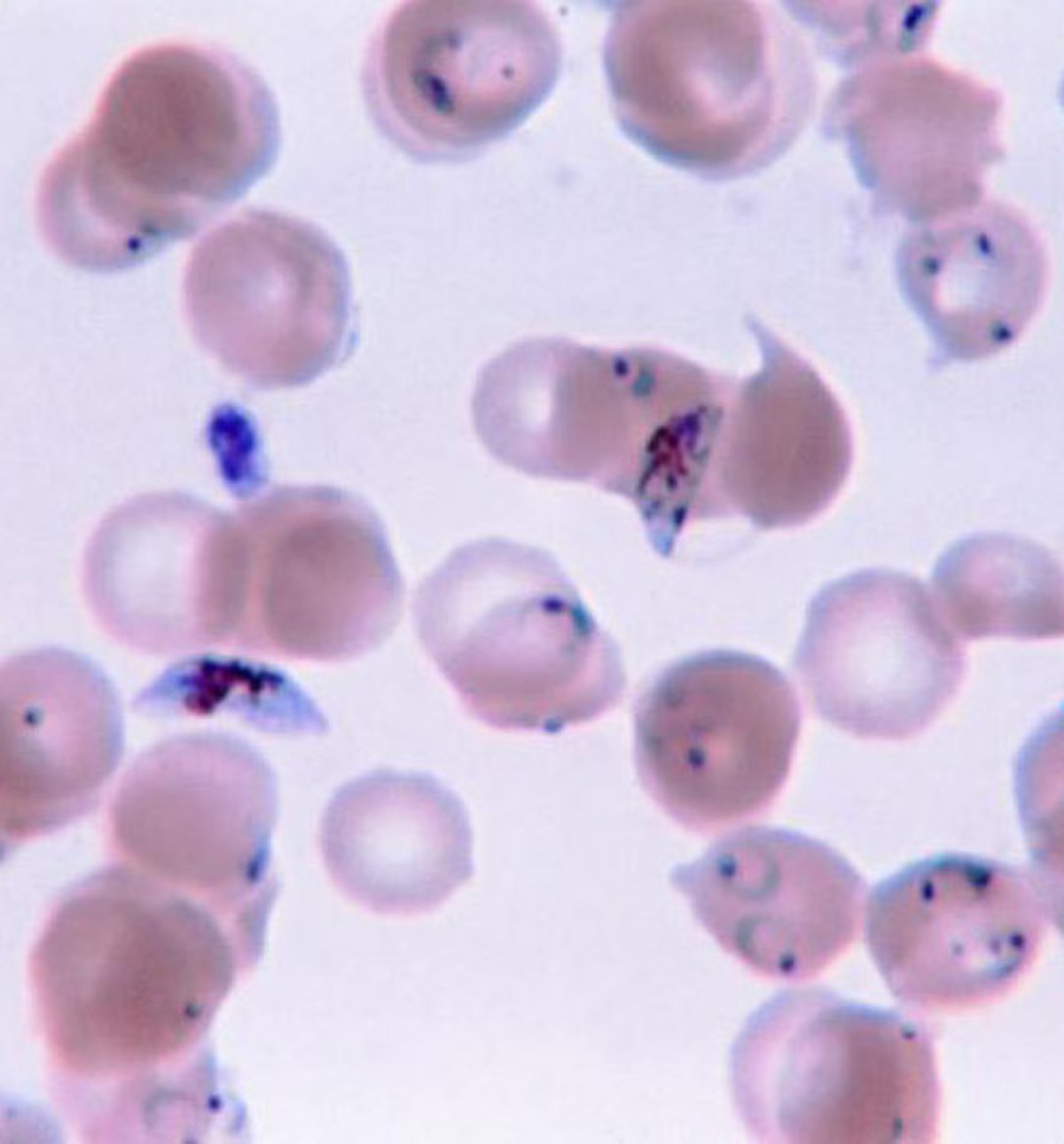
Le paludisme (du latin paludis, « marais »), aussi appelé malaria (de l'italien mal'aria, « mauvais air »), est une maladie infectieuse due à un parasite du genre Plasmodium, propagée par la piqûre de certaines espèces de moustiques anophèles.
Avec plusieurs centaines de millions de personnes malades chaque année et entre un et trois millions de décès par an, le paludisme demeure la parasitose la plus importante et concerne majoritairement les enfants de moins de cinq ans et les femmes enceintes. 80 % des cas sont enregistrés en Afrique subsaharienne (cf. section détaillée : « »).
Le parasite du paludisme est transmis lors de la piqûre par une femelle moustique du genre Anopheles, elle-même contaminée après avoir piqué un animal homéotherme impaludé. Le parasite infecte les cellules hépatiques de la victime puis circule dans le sang, en colonisant les hématies et en les détruisant. Cinq espèces de Plasmodium sont impliquées en pathologie humaine. La forme la plus grave du paludisme est causée par Plasmodium falciparum, responsable d'une grande majorité des décès. Plasmodium vivax, Plasmodium ovale, Plasmodium malariae et Plasmodium knowlesi provoquent des formes de paludisme « bénignes » qui ne sont généralement pas mortelles (cf. section détaillée : « »).
La cause de la maladie a été découverte le 6 novembre 1880 à l'hôpital militaire de Constantine (Algérie) par un médecin de l'armée française, Alphonse Laveran, qui reçut le prix Nobel de physiologie ou médecine en 1907. C'est en 1897 que le médecin anglais Ronald Ross (prix Nobel en 1902) prouva que les moustiques anophèles étaient les vecteurs de la malaria (jusqu'à cette date, le mauvais air émanant des marécages était tenu responsable de la propagation de la maladie).
Histoire
Depuis les origines de l'Homme

Le paludisme affecte les êtres humains depuis plus de 50 000 ans et aurait été un pathogène depuis le début de l'histoire de notre espèce. On trouve ainsi des parasites proches de celui de la malaria chez les chimpanzés, l'espèce la plus proche de l'Humain. Il y a environ 10 000 ans, le paludisme commence à avoir un impact majeur sur la survie humaine, ce qui coïncide avec le début de l'agriculture (révolution néolithique) donc à la sédentarisation. Une des conséquences (impact + modification du mode de vie) en est la sélection naturelle des gènes de la drépanocytose, des thalassémies, du déficit en glucose-6-phosphate déshydrogénase, de l'elliptocytose héréditaire (appelée dans certains cas ovalocytose). Ces maladies qui touchent les globules rouges du sang, donnent un avantage sélectif envers le paludisme (cf. section détaillée : « »).
Des fièvres mortelles - dont probablement le paludisme - ont été rapportées depuis les premiers écrits. On trouve ainsi des références à des périodes de fièvre paludique dès 2 700 avant J.-C. en Chine. Le plus ancien écrit concernant les infections dues à un parasite est le papyrus Ebers rédigé à Louxor en 1 500 avant J.-C. ; la découverte dans les momies de cette époque d'œufs calcifiés d'helminthes confirme le bien fondé des observations. En janvier 2010, une équipe de scientifiques égyptiens et américains ont prouvés, par l'analyse de l'ADN, que Toutânkhamon était atteint de paludisme au moment de son décès (v. -1327),. En Inde, dès l'antiquité, les Veda (« Textes de la connaissance ») font état des fièvres paludiques et les médecins Charaka et Sushruta (probablement Ve siècle av. J.-C.) en font une description et lui associent, déjà, la piqûre de moustique. Les symptômes de fièvre intermittente ont été décrits par Hippocrate; il lie ces fièvres à certaines conditions climatiques et environnementales, et les divise en trois types : febris tertiana (tous les deux jours), quartana (tous les trois jours), et quotidiana ou continua (maintenant appelée tropica). Vers 186 avant J.-C. apparaît, dans certaines régions de Chine, l'utilisation, en tisane, du qing hao su (青蒿素) appelé plus tard artémisinine en Occident et extrait d'une plante médicinale utilisée comme antipyrétique appelée qing hao (青蒿) (Artemisia annua ou « Armoise annuelle »).
Le paludisme était commun dans des endroits du monde où il est inconnu maintenant, comme en Europe et en Amérique du Nord. Dans certains endroits d'Angleterre, la mortalité due à la malaria était comparable à celle de l'Afrique subsaharienne d'aujourd'hui. Même si William Shakespeare est né au début d'une période plus froide appelée le « petit âge glaciaire », il connaissait suffisamment les ravages de cette maladie pour les citer dans huit de ses pièces. En France métropolitaine, la malaria n'a disparu que relativement récemment. Elle était encore présente en 1931, dans le marais poitevin, le golfe du Morbihan et en Camargue. Elle a été éradiquée de Corse, en 1973. Inconnu du temps de la présence romaine, le paludisme fut introduit lors des raids vandales. L'île connaîtra sa dernière épidémie de cas non importés à Plasmodium vivax de 1970 à 1973. Fait notable, en 2006 est survenu un cas autochtone à Plasmodium vivax sur l'île. Depuis, la quasi totalité des cas observés en France sont des paludismes d'importation. Plasmodium vivax a sévi jusqu'en 1958 dans les zones de Polder de Belgique et des Pays-Bas.
Dans les années 1500, ce sont les colons européens et leurs esclaves qui ont probablement amené le paludisme sur le continent américain (on sait que Christophe Colomb était atteint de cette maladie avant son arrivée dans les terres nouvelles). Les jésuites missionnaires espagnols virent que les Indiens riverains du lac de Loxa au Pérou utilisaient de la poudre d'écorce de Cinchona pour soigner les fièvres. Cependant, on ne trouve aucune référence au paludisme dans les ouvrages médicaux des Maya ou des Aztèques. L'utilisation de l'écorce de « l'arbre à fièvre » a été introduite dans la médecine européenne par les missionnaires jésuites dont Barbabe de Cobo qui l'expérimente en 1632 et l'exporte également; si bien que la précieuse poudre s'appela également « poudre des jésuites ».
Les facteurs critiques affectant la propagation ou l'éradication de la maladie ont été les comportements humains (déplacements de population, méthodes d'agriculture, etc.), le niveau de vie (la pauvreté était et reste la principale cause de mortalité) et la densité de la population (plus la densité humaine est grande et plus la densité de moustiques sera grande).
XVIIIe et XIXe siècles : premières études scientifiques
En 1717, la pigmentation post-mortem au graphite de la rate et du cerveau est publiée par Giovanni Maria Lancisi, le médecin du pape Clément XI, dans un ouvrage, édité en 1717, sur le paludisme De noxiis paludum effluviis eorumque remediis. Il y présente des preuves que la maladie est transmise par les mouches. Lancisi introduit le mot mal'aria, « mauvais air ».
En 1820, Pierre Joseph Pelletier et Joseph Bienaimé Caventou séparent les alcaloïdes cinchonine et quinine de la poudre de l'écorce de « l'arbre à fièvre », permettant la création de doses standardisées des composants actifs.
En 1848, Johann Friedrich Meckel von Helmsbach (surnommé Meckel le jeune) note un grand nombre de granules noir-bruns dans le sang et la rate d'un patient qui venait de mourir dans un hôpital psychiatrique. Meckel était probablement en train de voir des parasites de malaria sans le comprendre, car il ne mentionne pas le paludisme dans son rapport, en pensant que le pigment était de la mélanine.
En 1856, lors des essais, sans succès, pour synthétiser la quinine de façon commercialement viable, William Henry Perkin produit de la mauvéine par l'oxydation de l'o-toluidine. Avant cette découverte, les colorants et les peintures étaient issus de racines, de feuilles, d'insectes ou, dans le cas du pourpre, de mollusques. La découverte de Perkin des colorants artificiels permit de grandes avancées dans le domaine de médecine, de la photographie et d'autres domaines.
En 1865, Charles Ledger et un indien nommé Manuel font littéralement le trafic des graines de quinquina (Cinchona calisaya aussi appelé Cinchona Ledgeriana) en provenance de l'Équateur, du Pérou et de Bolivie. Des plantations sont alors établies sur l'île de Java par les Hollandais, après avoir acheté des graines aux Anglais, qui établissent, ainsi, un monopole mondial sur la quinine.
En 1880, Charles Louis Alphonse Laveran établit, en Algérie, la relation entre les observations faites par Meckel "le jeune" et le parasite qu'il observe pour la première fois dans les globules rouges de 44 personnes souffrant du paludisme. En voyant l'exflagellation se produire, il devient convaincu que les flagelles mobiles sont des micro-organismes parasites (minuscules êtres vivants unicellulaires qui se multiplient végétativement par mitose). Or bien des médecins de l'époque pensaient encore que les protozoaires n'étaient en fait que des globules rouges altérés. Laveran devra se battre pour faire admettre sa théorie car restait à trouver comment ces organismes s'introduisaient dans le corps humain. N'ayant pas obtenu un poste lui permettant de poursuivre ses recherches, Laveran prend sa retraite et poursuit ses recherches sur les protozoaires à l'Institut Pasteur en tant que bénévole. C'est en 1898 qu'il va publier son Traité du paludisme. Il voit aussi l'effet de la quinine, qui détruit ces parasites. Il suggère que le paludisme est causé par ce protozoaire. C'est la première fois qu'un protozoaire est identifié comme étant la cause d'une maladie. Cette découverte lui vaut l'attribution du prix Nobel de médecine en 1907. Les études scientifiques sur le paludisme viennent de faire leur première avancée significative.
En 1880, Ettore Marchiafava et Angelo Celli, à la demande d'Alphonse Laveran, étudient, au microscope, le cycle de reproduction du protozoaire dans le sang humain et observent qu'ils se divisent à peu près simultanément à intervalles réguliers et que la division coïncide avec les attaques de fièvre. En 1885, ils appellent ce protozoaire Plasmodium.
En 1881, Carlos Finlay, un médecin cubain qui traite les patients atteints de la fièvre jaune à La Havane, affirme que ce sont les moustiques qui transmettent cette maladie aux humains.
En 1884 le Dr Patrick Manson émet le premier l'hypothèse qu'il doit s'agir d'un moustique qui absorbe le parasite et pond dans l'eau que l'homme ingurgite.
En 1886 et 1892, Camillo Golgi publie ses découvertes sur la fréquence et la périodicité des fièvres dues à la malaria et montre qu'il existe plusieurs types de paludisme causés par des organismes protozoaires différents..
En 1891, Paul Ehrlich remarquent que le bleu de méthylène a une grande affinité pour certaines cellules et que ce colorant a de faibles propriétés antipaludéennes. Ehrlich veut promouvoir le développement de médicaments en exploitant les différences biochimiques.
En 1895, l'expédition française de Madagascar fut un « désastre sanitaire » : sur 21 600 hommes débarqués, 5 731 sont morts du paludisme et 25 sont morts au combat. À noter que ce genre de « désastre » se reproduira souvent comme pendant la guerre du Vietnam pour les soldats Nord-vietnamiens (voir l'article sur l'artémisinine).
En 1898, Amico Bignami réussit à transmettre expérimentalement le paludisme grâce à des moustiques. Il n’hésite pas à se faire piquer lui-même et à contracter la maladie.
En 1898, c'est le Britannique Ronald Ross, travaillant en Inde et correspondant régulièrement avec Laveran et Manson mais qui a du mal à imaginer pourquoi l'insecte ne transmet pas directement le parasite par piqûre, qui prouvera finalement que le paludisme est transmis par cette piqûre. Pour confirmer sa théorie, il dissèquera pendant deux ans des oiseaux paludéens qu'il faisait piquer par des centaines de variétés de moustiques et ce n'est qu'après ces deux ans, au bord du découragement, qu'il remarque une espèce de moustique qui ne se développe que dans les eaux de surface et ne se voit que la nuit : l'anophèle. Il continue alors ses recherches, il récolte et élève les larves et retrouve des protozoaires de Laveran vers le septième jour dans l'estomac de l'anophèle. La preuve est établie, c'est bien cet insecte qui transmet le parasite vivant à ses dépens. Il constate qu'une période d'incubation de 10 à 14 jours est nécessaire entre la piqûre et l'apparition des parasites dans le sang. Il venait de prouver que certaines espèces de moustiques transmettent le paludisme aux oiseaux, en isolant les parasites des glandes salivaires des moustiques qui se nourrissent des oiseaux affectés. Ceci lui vaut le prix Nobel de médecine en 1902. Après avoir démissionné des services médicaux indiens, Ross travaille pour l'école de médecine tropicale de Liverpool alors récemment créée, et dirige les efforts d'éradication du paludisme en Égypte, au Panama, en Grèce et sur l'île Maurice.
En 1899, le zoologiste italien Giovanni Battista Grassi, se basant sur les travaux de Ross (sur les oiseaux), fit de même pour le vecteur chez les humains et prouva que le cycle vital du Plasmodium a besoin du moustique comme étape nécessaire.
L'année suivante, les découvertes de Finlay et Ross sont confirmées par une équipe médicale dirigée par Walter Reed et les recommandations sont mises en place par William C. Gorgas lors de la construction du canal de Panama. Les mesures de santé publique ainsi adoptées ont sauvé les vies de milliers d'ouvriers (alors que plusieurs milliers d'autres y étaient morts auparavant) et ont aidé à développer les futures méthodes de lutte contre la maladie.
XXe et XXIe siècles : à la recherche de traitements

Au début du XXe siècle, avant les antibiotiques, les patients atteints de syphilis étaient volontairement « traités » en les infectant avec le paludisme, pour leur donner de la fièvre. Dans les années 1920, Julius Wagner-Jauregg commence à traiter les neurosyphilitiques avec le paludisme induit par P. vivax. Trois ou quatre accès de fièvre se révèlent assez pour tuer les bactéries de syphilis, tandis que l'infection de paludisme est arrêtée avec la quinine. En contrôlant précisément la fièvre avec la quinine, les effets des deux maladies peuvent alors être maitrisés. Bien que certains patients soient morts de la malaria, cette paludothérapie valait mieux qu'une mort certaine de la syphilis.
Le traitement thérapeutique par le paludisme fut également l'occasion d'accroître considérablement les connaissances sur la malaria ; il ouvrit la voie aux recherches en chimiothérapie et resta pratiqué jusque vers 1950. En 1974 , deux centres pratiquaient encore l'impaludation thérapeutique (l'un à Socola-Jassy en Roumanie, l'autre à Chamblee-Atlanta dans l'État de Georgie aux États-Unis).
La malariathérapie fut également utilisée pour traiter schizophrénie, oligophrénie avec schizophrénie greffée et grande agitation, psychoses affectives, chorée.
En 1922, Stephens, identifia le 4e parasite connu du paludisme chez l'homme, P. ovale.
La structure de la plasmoquine, ou paraquine, premier médicament antipaludique dérivé des aminoquinoloéines, découvert par les Allemands, n'est divulguée qu'en 1928. Les chercheurs britanniques, français et russes ont déjà remarqué l'action antipaludique des molécules de la série des amino-8 quinoléines. Ils se mettent à la recherche d'autres composés actifs. En 1930, Ernest Fourneau et son équipe mettent au point à l'Institut Pasteur la rhodoquine, efficace à des doses très inférieures à celles de la plasmoquine.
Dans les mêmes années 1930, aux laboratoires Elberfield de IG Farben en Allemagne, Hans Andersag et ses collègues synthétisent et testent environ 12 000 composants différents et arrivent à produire la Resochine®, un substitut de la quinine. Elle est liée à la quinine car elle possède un noyau de quinoline. Cette Resochine® (RESOrcinate d'un 4-aminoCHINoline : 7-chloro-4-[[4- (diethylamino) - 1 - methylbutyl] amino] quinoline) et un composant similaire, la Sontonchine (3-methyl Resochine) sont synthétisés en 1934 en coopération avec des entreprises américaines, grâce à plus de 2 000 accords entre IG Farben et des compagnies étrangères, comme Standard Oil of New Jersey, DuPont, Alcoa, Dow Chemical, Agfa, Winthrop Chemical Company et d'autres compagnies américaines. Ce médicament est plus tard appelé Chloroquine. C'est un inhibiteur de la biocristallisation des pigments et un des meilleurs antimicrobiens jamais créé. La quinine comme la chloroquine affectent les parasites de la malaria au début de leur cycle de vie, quand les parasites forment des pigments d'hématine, dérivant de la dégradation de l'hémoglobine.
Les propriétés insecticides du DDT (dichloro diphényl trichloro-éthane) sont établies, en 1939 par Paul Hermann Müller travaillant à Geigy Pharmaceutical à Bâle en Suisse grâce au Pyrethrum fait de Pyrèthre de Dalmatie (plante de la famille des chrysanthèmes) écrasée, l'épandage de DDT est une méthode standard de protection contre les insectes. Cependant, en raison de l'impact environnemental du DDT et de la résistance développée par les moustiques, le DDT est de moins en moins utilisé, surtout dans les zones où le paludisme n'est pas endémique (cf. section détaillée : « »).
En 1949, J.B.S. Haldane suggère que les thalassémiques hétérozygotes seraient plus résistants au paludisme. En novembre, Linus Pauling, Harvey Itano, S. J. Singer et Ibert Wells publient dans le journal Science la première preuve d'une maladie humaine causée par une protéine anormale. En utilisant l'électrophorèse, ils démontrent que les individus atteints de drépanocytose ont une hémoglobine modifiée, et que les hétérozygotes, qui ont à la fois des formes normales et anormales d'hémoglobine, sont plus résistants aux infections de paludisme. C'est aussi ainsi que l'on démontre que les lois de Mendel déterminent les propriétés physiques des protéines, et non pas seulement leur absence ou présence : c'est le début de la génétique moléculaire.
Pendant la guerre du Vietnam, en réponse à une demande expresse des « Việt Cộng », une étude systématique de plus de 200 plantes médicinales chinoises est entreprise sous la direction de la pharmatologue Youyou Tu et de son groupe de recherche à Pékin en 1972. Le qing hao su (青蒿素), appelé artémisinine en Occident, est extrait à faible température dans un milieu neutre (pH 7) de plantes de qing hao (青蒿) séchées, d'après les instructions de Ge Hong. Celui-ci était le premier, au IVe siècle à recommander l'utilisation de qing hao pour le traitement de « fièvres intermittentes » dans son livre Handbook of Prescriptions for Emergencies. Il recommande de faire tremper les feuilles et les branches de l'armoise pendant une nuit, d'extraire le jus amer et de le boire directement.
Les premières cultures du parasite à leur phase sanguine sont réalisées en 1976 par Trager et Jensen, dans des jarres à bougies, ce qui facilite considérablement le développement de nouveaux médicaments.
Bien que les différentes étapes sanguines et le vecteur du paludisme (l'anophèle) aient été identifiés dès le XIXe siècle, ce n'est qu'en 1980 que la forme latente (cycles exo-érythrocytaires secondaires qui vont entretenir dans le foie la parasitose pendant 3 à 5 ans ou plus pour P. Vivax, 2 ou 3 pour P. Ovale et pendant la vie entière pour P. Malariae) du parasite dans le foie est observée. La découverte de cette forme latente du parasite explique enfin pourquoi des individus apparaissent guéris du paludisme mais rechutent plusieurs années après que le parasite eut disparu de leur sang (cf. section détaillée : « »).
Le présent
Voir la section détaillée : « ».
Le futur
Pharmacologie
- En 2004, l'équipe du Dr Jonathan Vennerstrom de l'université du Nebraska d'Omaha réussit à synthétiser de l'acide artémisinique pouvant être converti en artémisinine plus efficace (in vitro) que celle produite naturellement. Cette molécule (OZ-277 ou RBx11160) n'a à ce jour produit aucune résistance connue de la part de Plasmodium.
- En mars 2006, deux équipes internationales ont montré l'efficacité de diverses plantes dont le Quassia. À la même date, des chercheurs de l'université de Lille I développaient une molécule, la « ferroquine », en greffant à un endroit précis de la molécule de chloroquine un ferrocène. La ferroquine serait jusqu'à 30 fois plus efficace que la chloroquine. Aucun cas de résistance chez P. falciparum n'est apparu (tant sur des isolats de terrain que sur des lignées de parasites entretenues en laboratoire).
- En septembre 2006, une équipe française avait isolé un principe antipaludique (la simalikalactone D) de la tisane de Quassia amara utilisée en Guyane contre le paludisme.
- En 2008, des biologistes du Georgia Institute of Technology d'Atlanta révélaient que certains composés fongicides naturels de l'algue rouge Serratus Callophycus inhibent l'action du Plasmodium bien que le lien entre activité antifongique et antipaludique ne soit pas encore compris.
- En janvier 2010, GlaxoSmithKline a annoncé rendre gratuitement accessible à la communauté scientifique une liste de plus de 13 500 molécules - ainsi que leurs structures chimiques - potentiellement actives contre P.falciparum afin de stimuler le développement de nouveaux traitements contre la maladie.
Les vaccins
Le premier vaccin antipaludéen, le SPf66, basé sur un peptide synthétique, fut mis au point en janvier 1986 par Manuel Elkin Patarroyo. Son efficacité était toutefois assez faible voire nulle pour P.falciparum.
Actuellement trois types de recherche de deuxième génération sont basées sur les antigènes issus des différents stades du cycle évolutif parasitaire :
- vaccins anti-stade exo-érythrocytaire : ils visent à empêcher le sporozoïte de pénétrer ou de se développer dans les cellules hépatiques ;
- vaccins anti-stade sanguin asexué (antimérozoïte) : ils empêchent les mérozoïtes de pénétrer ou de se développer dans les hématies ;
- vaccins bloquant la transmission : ils induisent des anticorps empêchant la maturation des stades sexués du parasite chez l'anophèle.
Depuis 1992, un vaccin antimérozoïte prometteur appelé RTS, S/AS02A est en développement chez GlaxoSmithKline Biologicals à Rixensart en Belgique. En décembre 2005, le professeur Alonso de l'université de Barcelone publie des résultats encourageants car il s'avèrerait efficace, dès la 1re injection, dans 30 % des cas et éviterait la moitié des crises graves. Depuis le 26 mai 2009, il est au stade de la phase III des essais cliniques et les tests montrent que son efficacité sera supérieure aux espoirs. Il est préparé à partir de peptides parasitaires de synthèse et de protéines recombinantes (capable d'échanger des informations génétiques avec une autre protéine) ou d'ADN (découvert dans les mitochondries et les apicoplastes de Plasmodium). Sachant que le parasite, pour pénétrer les hématies, prend la forme d'une protéine et est capable de muter une soixantaine de fois pour tromper le système immunitaire, cette piste utilise deux protéines recombinantes qu'elle fusionne :
- une partie de la protéine circumsporozoïtaire (CSP = Circum Sporozoïte Protein) de P. falciparum (RTS);
- l'antigène de surface du virus de l'hépatite B (S);
- un adjuvant qui est composé de 250 µl d'émulsion d'huile dans l'eau, de 50 µg de saponine QS21 et de 50 µg de (MPL™) lipide monophosphoryque immunostimulant A (AS02A).
C'est le vaccin de deuxième génération le plus avancé. Si toutes les études et les tests continuent à se dérouler normalement, il pourra être commercialisé au début de 2012, en conformité avec l'article 58 de l'Agence européenne des médicaments, et entrer en phase IV des essais cliniques.
D'autres chercheurs visent une solution vaccinale :
- Depuis 2002, la Faculté de biologie et de médecine (FBM) de l'Université de Lausanne en Suisse étudie un vaccin antimérozoïte appelé PfCS102/AS02A basé sur une peptide de synthèse circumsporozoïtaire (PfCS = Peptide Circum Sporozoïte Protein) de P. falciparum (PfCS102) renforcée par un adjuvant. Au départ, cet adjuvant fut le Montanide ISA 720 remplacé depuis par l'AS02A de GSK Bio car donnant une meilleure réponse du système immunitaire. Les résultats obtenus sont comparables au RTS, S/AS02A. Il est,depuis 2005, dans le stade de la phase II des essais cliniques.
- En novembre 2005, l'Institut Pasteur annonçait le début de la phase I des essais cliniques sur l'être humain d'un prototype de vaccin antimérozoïte basé sur les antigènes et appelé MSP3. Pour le concevoir, les chercheurs ont étudié les mécanismes des personnes naturellement immunisées.
- En 2006, le Département de la Défense des États-Unis (DoD) demande à l'Institut de Médecine (IOM) de l'Académie nationale des Sciences (NAS) de reprendre le programme de recherche qu'il avait entamé en 1986 visant un vaccin pour les militaires contre P.falciparum.
- De novembre 2006 à décembre 2007, la faculté de médecine de l’université du Maryland et l'université de Bamako testaient ensemble en phase I des essais cliniques un vaccin FMP2.1/AS02A. Sa substance active est une protéine issue de P.falciparum (FMP2.1) et elle est renforcée par l'adjuvant AS02A. Un test effectué à Bandiagara au Mali sur 100 enfants âgés de 1 à 6 ans a démontré que l'accoutumance pharmacodynamique à la substance active était sans danger et que la réponse immunitaire 1 an après la vaccination restait élevée. Sur cette base, la même équipe est passée à phase II des essais cliniques de mai 2007 à juillet 2009 sur 400 enfants.
- En janvier 2010, L'University of Central Florida d'Orlando a annoncé un candidat-vaccin oral ou injectable à la fois efficace contre le paludisme et le choléra. Il cible l'immunité systémique et mucosale, via une construction antigénique fusionnant les épitopes de la sous-unité B (CTB) de la toxine cholérique avec des antigènes de la membrane apicale (AMA1) et d'une protéine de surface (MSP1) des mérozoïtes de P. falciparum.
Les chloroplastes d'un tabac et d'une laitue transplastomiques ont été testés comme réacteurs pour produire ces protéines.
Selon l'étude, ces dernières, extraites et injectées à des souris se sont montrées capables de les protéger durant 300 jours contre la pénétration du parasite dans les globules rouges, et contre la toxine cholérique. La réponse immunitaire serait de type Tr1/Th2. Ce procédé a été breveté et pourrait permettre - s'il se montre aussi efficace chez l'Homme - de produire un vaccin peu cher, et ne nécessitant pas de stockage réfrigéré en cas d'usage oral.
La génétique
Les recherches génétiques visent plutôt à combattre le parasite, non pas chez l'homme mais, chez le moustique.
En 2000, l'équipe du Professeur Andrea Crisanti de l'Imperial College London parvient a créer le premier moustique génétiquement modifié. Malheureusement, en 2003, elle est en devoir d'annoncer que si le gène marqueur persiste pendant une trentaine de générations lors de la fécondation entre moustiques modifiés, celui-ci ne subsiste que pendant 4 à 16 générations lors d'une fécondation avec un moustique non modifié.
Depuis avril 2001, un consortium international visant le séquençage complet du génome d’Anopheles gambiae a vu le jour. Il est patronné par le Tropical Disease Research (TDR). Ce séquençage a été confié d'une part au Genoscope d'Évry et au Celera Genomics d'Alameda. Le but est d'identifier les gènes impliqués dans l’immunité du moustique vis-à-vis des parasites des Plasmodium ou dans ses récepteurs olfactifs et gustatifs avec, à terme, la conception de molécules attractives ou répulsives pour le moustique ainsi que cibler les protéases impliquées dans sa réponse immunitaire.
Le 15 juillet 2010, le professeur d'entomologie Michael Riehle annonce avoir réussi à créé avec son équipe de chercheurs de l'université d'Arizona, un Anopheles Stephensi femelle génétiquement modifié parfaitement armé pour détruire les parasites dans son corps et donc incapable de transmettre la maladie. les chercheurs étudient maintenant le moyen de remplacer, dans la nature, les populations d'anophèles « classiques » par ceux de laboratoire.