Paludisme - Définition
La liste des auteurs de cet article est disponible ici.
Causes
Le paludisme est causé par des parasites de l'espèce Plasmodium, eux-mêmes transmis par les moustiques du genre Anopheles.
Le Plasmodium, parasite du paludisme
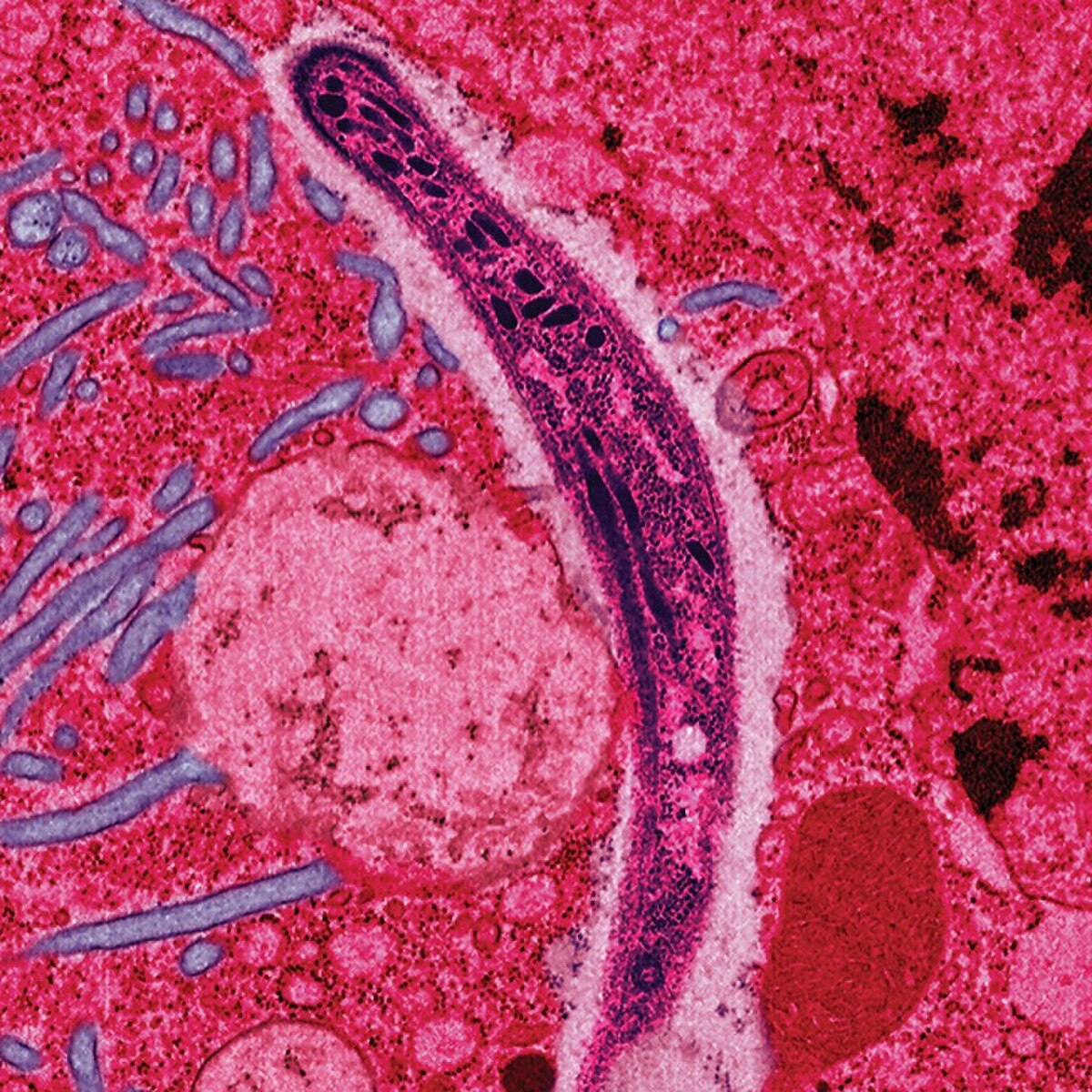
Le paludisme est causé par un parasite protozoaire du genre Plasmodium (Phylum apicomplexa). Chez les humains, le paludisme est, essentiellement, causé par P. falciparum (prépondérant en régions tropicales), P. malariae, P. ovale (espèce la plus rare, hormis l'Afrique de l'Ouest) et P. vivax (espèce la moins exigeante en température).
P. falciparum est la cause la plus commune des infections et responsable d'environ 80 % de tous les cas de paludisme ainsi que 90 % des décès. Les Plasmodium infectent également les oiseaux, les reptiles, les singes, les chimpanzés et les rongeurs (animaux à sang chaud). On a rapporté des cas d'infections humaines avec des espèces simiesques du paludisme, dont P. knowlesi, P. inui, P. cynomolgi, P. simiovale, P. brazilianum, P. schwetzi et P. simium. Cependant, à l'exception de P. knowlesi, ces infections restent limitées et sans importance en termes de santé publique. Le paludisme aviaire peut tuer les poulets et les dindes, mais cette maladie ne cause pas de dommages économiques notables à l'agriculture. Cependant, depuis qu'il a été introduit par les humains, le paludisme a décimé les espèces endémiques d'oiseaux d'Hawaii, qui avaient évolué, en son absence, sans défense contre celui-ci.
Le Plasmodium se présente sous la forme d'un protozoaire très petit (1 à 2 µ selon les formes). La coloration au May-Grünwald-Giemsa montre qu'il est constitué d'un cytoplasme bleu pâle entourant une vacuole nutritive claire et contenant un noyau rouge et du pigment brun-doré ou noir (hémozoïne).
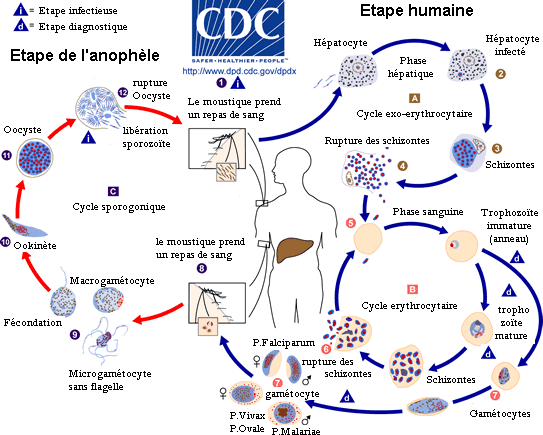
Le cycle évolutif du Plasmodium est assez complexe et nécessite deux hôtes, un hôte définitif : l'homme et un hôte primaire : la femelle hématophage d'un moustique du genre Anopheles (du grec anôphelês signifiant : inutile). D'un point de vue strictement biologique, le véritable hôte définitif est le moustique (la reproduction sexuée parasitant l'anophèle). L'homme ne serait qu'un hôte intermédiaire dans son cycle réplicatif. Néanmoins, pour des raisons anthropocentriques, on considère que le vecteur n'est pas l'homme mais le moustique et par conséquent que cette zoonose est du type zooanthroponose.
L'anophèle, vecteur du paludisme
Technique de chasse de l'anophèle
Seules les femelles sont hématophages. Les mâles dont les seules activités sont la reproduction de l'espèce et voler de-ci de-là pour se nourrir de jus de plantes et de nectar ne transmettent pas la maladie.
Les femelles anophèles se nourrissent de préférence la nuit, et commencent à chercher leur repas au crépuscule, en continuant pendant la nuit jusqu'à ce qu'elles l'aient trouvé.
Lorsque les humains ou les animaux respirent, ils produisent du CO2 et leur corps dégage constamment de la chaleur et de l'humidité (transpiration) ainsi que beaucoup d'autres substances attractives comme l'acide lactique ou le sébum. Les moustiques, ainsi que d'autres insectes piqueurs, sont capables de détecter toutes ces émanations depuis de longues distances (± 20 m pour le CO2) et sont immédiatement attirés par ces sources. Les moustiques sont également attirés par les vapeurs d'alcool ou par les couleurs foncées et plus spécialement le noir. Pour ce faire, ils volent de-ci de-là (maximum 2 km) en utilisant leurs capteurs.
| Nom de la zoonose | Cause | Transmission | Vecteur |
|---|---|---|---|
| Le jour La nuit | femelle Aedes femelle Anopheles funestus | ||
| Virus | Le jour | femelle Aedes | |
| Encephalite japonaise | Virus | La nuit | femelle Culex |
| Virus | Le jour | femelle Aedes | |
| Filariose lymphatique | Parasite | La nuit | femelle Anopheles |
| O'nyong-nyong | Virus | La nuit | femelle Anopheles |
| Paludisme | Parasite | La nuit | femelle Anopheles |
Cycle du parasite chez l'anophèle
Le vecteur du parasite ainsi que son hôte primaire est la femelle d'un moustique du genre Anophèle. Les jeunes moustiques ingèrent le parasite pour la première fois lorsqu'ils se nourrissent du sang (nécessaire à cette femelle pour sa production d'œufs) d'un sujet humain infecté. Le moustique infecté transporte ensuite les gamétocytes du Plasmodium dans leurs glandes salivaires. Une fois déglutis, ils passent dans le sang en traversant l'épithélium salivaire pour se différencier en gamètes mâles et femelles qui s'unissent pour former un zygote mobile appelé ookinète qui pénètre la paroi stomacale pour devenir un oocyste sphérique dont le noyau va se diviser sans fin pour former des sporozoïtes. La durée de cette maturation est étroitement dépendante de la température extérieure. Par exemple pour P. falciparum : pas de maturation en dessous de 18 °C ou au-dessus de 35 °C, elle est maximale vers 24 °C. Quand l'oocyste rompt, il relâche les sporozoïtes qui migrent dans le corps du moustique jusqu'aux glandes salivaires d'où ils peuvent, lors d'un nouveau repas de sang, infecter un nouvel hôte humain, en traversant la peau, avec la salive contenant aussi des anticoagulants et des enzymes.
Cycle du parasite chez l'humain
Phase hépatique
Mince fuseau de 12 µ / 1 µ, le sporozoïte infectieux injecté à l'homme, lors de cette piqûre par une femelle d'anophèle infectée, circule rapidement (moins d'une demi-heure) dans le sang jusqu'au foie dans lequel il est séquestré en grande partie grâce aux motifs adhésifs de la protéine majoritaire de son enveloppe (protéine circumsporozoïte ou CSP = Cysteine String Protein), pour ensuite infecter les hépatocytes. Cette crise pré-érythrocytaire hépatique qui va durer 6 jours pour P. falciparum, 8 jours pour P. vivax, 9 jours pour P. ovale et probablement 12 jours pour P. malariae permettra au parasite de poursuivre son cycle. Les sporozoïtes qui n'atteindront pas le foie seront soit éliminés par les phagocytes, soit incapables de poursuivre leur évolution s'ils atteignent d'autres organes.
Une première transformation arrondit cette forme « cryptozoïte » (du grec κρυπτός (kruptos) signifiant « caché ») en un élément uninucléé (avec un seul noyau) appelé trophozoïte qui est l'occasion pour le parasite de se multiplier directement (il en est toujours ainsi pour P. falciparum), par schizogonie, pendant une semaine à quinze jours aboutissant à un énorme schizonte (nom donné au protozoaire lorsqu'il devient actif après la phase d'incubation) de 40 à 80 µ. Ce corps bleu (parce que constitué d'un cytoplasme bleu pâle lorsqu'il est coloré au May-Grünwald-Giemsa) bourgeonne, tout en perdant de sa mobilité, de manière à émettre des vésicules, contenant les jeunes mérozoïtes qui seront transférés dans le sang, initiant ainsi le stade érythrocytaire, c'est-à-dire l'infection des globules rouges.
Cependant, certains mérozoïtes de P. ovale ou P. vivax peuvent rester cachés dans le foie plusieurs années, voire la vie entière pour P. malariae, avant de se réactiver en vagues successives. Cette phase du parasite est appelée « phase dormante » : le Plasmodium ne se réplique pas mais dort, d'où les noms qui lui sont donnés à ce moment-là : « hypnozoïte » (du grec Ὕπνος qui est Hypnos l'antique dieu grec du sommeil).
Phase de transfert
Les vésicules sont libérées dans les sinusoïdes hépatiques (vaisseaux capillaires du foie faisant la jonction entre celui-ci et le réseau sanguin) pour rejoindre ensuite la circulation sanguine et y répandre un flot de jeunes mérozoïtes « pré-érythrocytaires » prêts à infecter les globules rouges. Chaque cellule de foie infectée contient environ 100 000 mérozoïtes (chaque schizonte est capable de produire 20 000 mérozoïtes). C'est une véritable technique de « Cheval de Troie » qui est ici utilisée pour passer des cellules hépatiques au sang. L'imagerie in vivo a montré en 2005-2006 chez des rongeurs que les mérozoïtes étaient capables de fabriquer des cellules mortes leur permettant de quitter le foie pour la circulation sanguine en échappant ainsi au système immunitaire). Ils semblent à la fois guider ce « véhicule » et s'y cacher en masquant les signaux biochimiques qui alertent normalement les macrophages. Il y a peut-être là une piste nouvelle pour des médicaments actifs ou un vaccin anti-stade exo-érythrocytaire avant le stade de l'invasion des globules rouges.
Phase sanguine
Au début de la longue phase sanguine : les mérozoïtes s'accolent aux globules rouges, les envahissent, s'y développent en trophozoïtes puis s'y divisent (schizontes). En se diffusant, les mérozoïtes font éclater les globules rouges (c'est l'hémolyse). Ce sont ces éclatements brutaux et synchrones qui sont à l'origine des accès de fièvre. Le temps qui s'écoule entre la pénétration d'un parasite dans un globule rouge et l'éclatement de celui-ci est assez constant et atteint chez l'être humain 48 heures pour P. vivax, P. ovale et P. falciparum (fièvres tierces) et 72 heures pour P. malariae (fièvre quarte). La destruction des globules rouges provoque une anémie et, dans le cas du paludisme cérébral (voir le sous titre sur ce sujet), la mort intervient à la suite d'une obstruction des vaisseaux sanguins du cerveau par les globules rouges infectés. Cette destruction de globules rouges s'accompagne de la libération d'hémozoïne, qui va perturber le fonctionnement de l'hypothalamus (production de cytokine comme le TNFα) et causer de très fortes fièvres qui peuvent aller jusqu'à l'hyperpyrexie.
L'éclatement des schizontes mûrs ou « rosaces » termine le premier cycle schizogonique érythrocytaire en libérant dans le sang, avec les déchets du métabolisme plasmodial (pigments et débris cellulaires du globule rouge), une nouvelle génération de plasmodiums, les mérozoïtes « érythrocytaires » capables de réinfecter d'autres globules rouges.
Une succession régulière de cycles semblables va suivre, qui seront progressivement remplacés (les défenses immunitaires s'organisant) par des cycles érythrocytaires gamogoniques préparant les formes sexuées. Les trophozoïtes arrêtent de se diviser et modifient leur rapport nucléo-plasmatique. Ces formes de trophozoïtes avec un noyau volumineux et un cytoplasme densifié sont des gamétocytes mâles et femelles, qui vont demeurer en attente dans le sang.
Les parasites lors de cette phase n'ont aucune chance de survie dans l'être humain : ils restent vivants une vingtaine de jours puis disparaissent. Ils ne pourront poursuivre leur évolution que chez le moustique. À ce moment si un anophèle femelle pique une personne malade, il absorbe des gamétocytes contenus dans le sang, et un nouveau cycle, sexué cette fois, débute dans le moustique. Les sporozoïtes produits par cette reproduction passent dans la salive du moustique, qui peut infecter un nouvel hôte, et ainsi de suite...
Remarque
Pour P. Falciparum c'est là tout le cycle de vie. Avec les autres Plasmodium, certains mérozoïtes pré-érythrocytaires, ne gagnent pas le sang directement, mais s'attaquent à de nouveaux hépatocytes : c'est le début des cycles exo-érythrocytaires secondaires qui vont entretenir dans le foie la parasitose pendant deux ou trois ans pour P. Ovale, 3 à 5 ans ou plus pour P. Vivax et pendant la vie entière pour P. Malariae.
Animation et schéma du cycle parasitaire du Plasmodium
- Animation Adobe Flash Player
- Schéma
Autres causes de transmission
Les parasites peuvent aussi être transmis par voie placentaire de la mère au fœtus (paludisme congénital), par partage d'une seringue souillée ou par transfusion sanguine, bien que ce dernier moyen de transmission soit assez rare.
