Palladium (chimie) - Définition
La liste des auteurs de cet article est disponible ici.
Production et occurrence dans le monde
On rencontre le palladium à l'état natif (sous forme de métal) finement divisé. Le minéral le plus important est le stibiopalladinite (Pd5Sb2). Il est associé au platine dans la plupart des minerais.
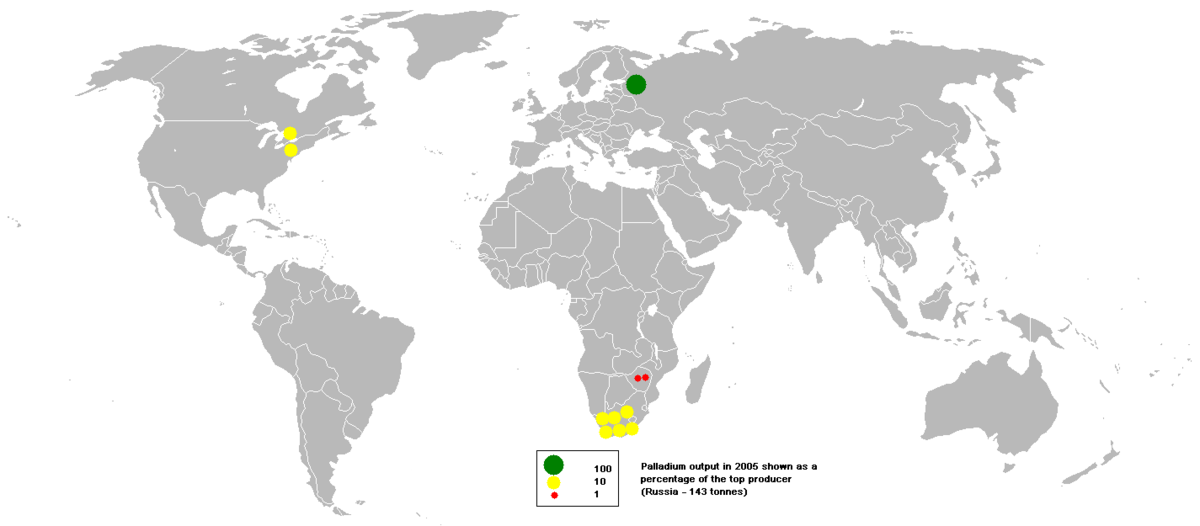
En 2007, la Russie était le premier exportateur de palladium avec un part mondiale de production de 44%, suivie par l'Afrique du Sud, 40%. Le Canada (6%) et les États-Unis (5%) sont les seuls autres producteurs signifiants de palladium.
Le palladium peut être trouvé comme métal libre allié avec l'or et autre métaux du groupe du platine dans des dépôts d'orpaillage dans l'Oural, l'Australie, l’Éthiopie, l'Amérique du Nord et du Sud. Ces dépôts ne jouent toutefois qu'un rôle mineur dans la production de palladium. Les gisements majeurs pour le commerce du palladium sont les dépôts de nickel-cuivre dans le bassin de Sudbury (en) en Ontario et les dépôts de Norilsk–Talnakh en Sibérie. L'autre grand dépôt de métaux du groupe du platine est le dépôt de Merensky Reef (en) qui fait partie du complexe igné du Bushveld (en) en Afrique du Sud. Le complexe igné de Stillwater (en) dans le Montana et le gisement de Roby du complexe igné du Lac des Îles (en) sont les deux autres sources de palladium au Canada et aux États-Unis.
Le palladium est également produit dans les réacteurs de fission nucléaire et peut être extrait du combustible nucléaire irradié même si la quantité produite est minime.
Du palladium peut aussi être trouvé dans les minéraux rares coopérite (en) et polarite (en).
Le palladium est une ressource non renouvelable.
Composés du Palladium
La palladium existe principalement aux degrés d'oxydation 0, +2 et +4, ce dernier étant plutôt rare. Un exemple étant l'hexachloropalladate(IV).
Le palladium élémentaire réagit avec le chlore pour donner le chlorure de palladium(II), celui-ci se dissout dans l'acide nitrique et précipite sous forme de acétate de palladium(II) après addition d'acide acétique. Ces deux sels de palladium ainsi que le bromure de palladium(II) sont réactifs et relativement peu coûteux, ce qui fait qu'il sont très utilisés comme précurseurs dans la chimie du palladium. Tous les trois ne sont pas des monomères, le chlorure et le bromure nécessitent d'être chauffés à reflux dans l'acétonitrile pour obtenir des complexes d'acétonitrile, qui eux sont des monomères très réactifs.
- PdX2 + 2MeCN → PdX2(MeCN)2 (X=Cl, Br)
Le chlorure de palladium(II) est le principal précurseur de nombreux autres catalyseurs à base de palladium. Il est, entre autres, utilisé pour la préparation de catalyseurs hétérogènes tels que le palladium sur sulfate de barium, le palladium sur carbone, et le chlorure de palladium sur carbone. Il réagit avec la triphénylphosphine dans des solvants coordinants pour donner le dichlorobis(triphénylphosphine)palladium(II), un catalyseur utile qui peut être formé in situ.
- PdCl2 + 2PPh3 → PdCl2(PPh3)2
La réduction de ce complexe avec l'hydrazine (N2H4) avecplus de triphénylphosphine donne le tetrakis(triphénylphosphine)palladium(0), un des deux complexes de palladium(0) majeurs.
- PdCl2(PPh3)2 + 2PPh3 + 2,5N2H4 → Pd(PPh3)4 + 0,5N2 + 2N2H5+Cl-
L'autre complexe d'importance du palladium(0), le tris(dibenzylidèneacétone)dipalladium(0) (Pd2(dba)3), est synthétisé par réduction du hexachloropalladate(IV) de sodium en présence de dibenzylidèneacétone.
La très grande majorité des réactions dans lesquelles le palladium joue le rôle de catalyseur sont connues sous le nom de réactions de couplage pallado-catalysées. Des exemples célèbres sont la réaction de Heck, la réaction de Suzuki ou encore la réaction de Stille. Des complexes tels que l'acétate de palladium(II), le tetrakis(triphénylphosphine)palladium(0) ou encore le tris(dibenzylidèneacétone)dipalladium(0) sont souvent utilisés dans de telles réactions, que ce soit en tant que catalyseur, ou comme précurseurs à d'autres catalyseurs. Un problème gênant lors des catalyses au palladium est le risque que ces composés se décomposent à haute température pour donner du palladium élémentaire, soit sous la forme d'un composé noir (« Palladium noir »), soit sous la forme d'un « miroir » déposé sur les parois du réacteur.