Nitrate de plomb(II) - Définition
La liste des auteurs de cet article est disponible ici.
Chimie
Lorsque le nitrate de plomb (la où le plomb est au nombre d'oxydation : +II) est chauffé, il se décompose en oxyde de plomb(II), accompagné d'un bruit de craquement (appelé parfois décrépitation), selon la réaction suivante :
- 2 Pb(NO) → 2 PbO(s) + 4 NO(g) + O(g)
Cette propriété conduit le nitrate de plomb à être parfois utilisé en pyrotechnie (et plus particulièrement dans les feux d'artifice).
Chimie en solution aqueuse
Le nitrate de plomb (II) se dissout dans l'eau pour donner une solution claire et incolore. Cette solution réagit avec les iodures solubles comme par exemple l'iodure de potassium (KI) en produisant un précipité d'iodure de plomb(II) de couleur jaune-orange claire.
- Pb(NO)(aq) + 2 KI(aq) → PbI(s) + 2 KNO(aq)
Cette réaction est souvent utilisée pour démontrer la réaction chimique de précipitation, en raison du changement de couleur observé.
Excepté le nitrate de plomb(II), l'acétate de plomb(II) est le seul autre composé de plomb commun soluble dans l'eau. Les autres composés de plomb sont insolubles dans l'eau, y compris les habituellement solubles chlorures et sels de sulfates comme le chlorure de plomb(II) et le sulfate de plomb(II). Ceci signifie que le nitrate de plomb(II) est un composé de premier plan pour la production de composés de plomb insoluble via une double décomposition.
Quand 1 M de solution d'hydroxyde de sodium est ajouté à 0,1 M de nitrate de plomb, des nitrates basiques sont formés, même une fois dépassé point d'équivalence. Jusqu'à la demie équivalence, Pb(NO)·Pb(OH) prédomine, puis, au-delà, Pb(NO3)2·5Pb(OH)2 est formé. De manière étonnante, il n'y pas de Pb(OH) simple jusqu'à un pH de 12.
Structure cristalline
La structure cristalline du nitrate de plomb(II) solide a été déterminée par diffraction de neutrons.. Le composé cristallise dans un système cubique avec les atomes de plomb dans un sous-système cubique à faces centrées, le paramètre de maille étant de 784 picomètres (soit 7,84 angströms). Son groupe d'espace est le
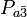
Sur la figure (tracée pour le plan cristallographique [111]), les points noirs représentent les atomes Pb, les points blancs les groupes nitrate 27 pm au-dessus du plan des atomes de plomb, et les points bleus les groupes nitrates à la même distance en dessous de ce plan. Dans cette configuration, chaque atome Pb est lié à 12 atomes d'oxygène (longueur de liaison chimique : 281 pm). Toutes les liaisons N—O sont identiques (125 pm).
L'intérêt académique de la structure cristalline de ce composé était partiellement fondé sur la possibilité d'une rotation interne libre des groupes nitrate dans la maille cristalline à températures élevées, ce qui ne s'est cependant pas matérialisé.
Complexation
Le nitrate de plomb possède une chimie supramoléculaire intéressante en raison de la coordinence des atomes d'azote et d'oxygène, donneurs d'électrons. Intérêt largement académique, mais source d'applications potentielles. Ainsi, la combinaison du nitrate de plomb(II) avec le pentaéthylène glycol dans une solution d'acétonitrile et de méthanol, suivie d'une évaporation lente produit un nouveau matériau cristallin, [Pb(NO)(EO)]. La structure cristalline de ce composé montre que la chaîne PEO est enroulée autour de l'ion plomb dans un plan équatorial, de manière similaire à un éther couronne. Les deux ligands nitrate bidendates se situent en configuration trans. Le nombre de coordination total est 10 avec l'ion plomb dans une géométrie moléculaire antiprisme carré bicouvert.
Le complexe formé par le nitrate de plomb(II), le perchlorate de plomb(II) et un ligand bithiazole donneur N bidentate est binucléaire avec un groupe nitrate formant un pont entre les atomes de plomb avec un nombre de coordination de 5 et 6. Un aspect intéressant de ce type de complexe est la présence d'un gap physique dans la sphère de coordination (c.-à-d. les ligands ne sont pas placés symétriquement autour de l'ion métal), ce qui est probablement imputable à la paire d'électrons non liée du plomb. Le même phénomène est décrit pour des complexes de plomb avec pour ligand l'imidazole.
Ce type de chimie n'est pas toujours spécifique au nitrate de plomb, d'autres composés de plomb(II) comme le bromure de plomb(II) formant aussi des complexes, mais il est utilisé fréquemment en raison de ses propriétés de solubilité et de sa nature bidendate.