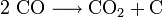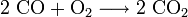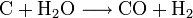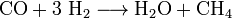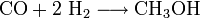Monoxyde de carbone - Définition
La liste des auteurs de cet article est disponible ici.
Chimie
Les orbitales moléculaires qui décrivent la structure du monoxyde de carbone sont semblables à celle du diazote N. Les deux molécules ont chacune quatorze électrons et quasiment la même masse molaire. Il faut toutefois tenir compte de l'électronégativité plus importante de l'atome d'oxygène. La molécule présente un moment dipolaire avec une légère charge partielle positive sur le carbone. Cet atome de carbone est divalent dans le mésomère C=O, c'est donc un carbène. Cependant, l'isomère de résonnance –C≡O+ est la forme prédominante. D'ailleurs, la distance interatomique de 0,112 nm correspond plutôt à une triple liaison.
Propriétés chimiques
CO est un gaz incolore et inodore à température et pression normales, très peu soluble dans l'eau. Ses points d'ébullition et de fusion, et surtout sa densité gazeuse sont proches de ceux de l'azote moléculaire. Mais l'asymétrie d'électronégativité explique qu'il est beaucoup plus réactif que l'azote et joue un rôle de ligand dans des complexes métalliques. Sa toxicité, présentée dans une partie spécialisée ci-dessous, ou sa métastabilité en dessous de 950 °C en sont une preuve.
Le premier sens de l'équation réversible de Boudouart est une réaction de décomposition chimique.
avec une variation d'enthalpie de 39 kcal/mol. La cinétique de cette réaction réversible est favorisée par des surfaces de métaux et d'oxydes métalliques, par exemple le fer et ses oxydes. Si la réaction a lieu avec une cinétique suffisante, elle est à moitié réalisée vers 700 °C, complète en dessous de 400 °C.
Le gaz CO est absorbé par une solution saturée de chlorure cuivreux dans HCl. Ce précipité, composé d'addition sous forme de cristaux blancs permettait avec l'appareil Orsat de doser de manière volumétrique le CO parmi d'autres gaz. L'analyse de ce gaz industriel, combustible, était commune bien avant 1880.
Combustion et vieux usages industriels
Le monoxyde de carbone réagit avec le dioxygène pour former du dioxyde de carbone suivant la réaction exothermique
avec une variation d'enthalpie de -67,5 kcal/mol. C'est pourquoi il était préparé en quantité considérable dans le gazogène de type Siemens. Ce gaz à l'air combustible est simplement le produit d'une première combustion incomplète de couche de charbon.
La pyrolyse de la houille donne aussi un gaz qui en contient environ un dixième en masse (gaz de houille, autrefois servant à l'éclairage ou gaz de cokerie). En termes de la pyrolyse (ce qui était interdit dans la législation française sur le gaz d'éclairage) ou sur un charbon porté au rouge, la projection d'eau ou de vapeur d'eau permet d'obtenir le gaz à l'eau, encore appelé après purification gaz de synthèse.
Cette réduction de la vapeur d'eau est conduite à 500 °C, catalysée sur un lit de FeO et d'oxydes métalliques. Cette réaction autrefois commune en carbochimie est endothermique, avec une variation d'enthalpie libre de 10 kcal/mol.
Le monoxyde de carbone est le gaz réducteur des divers oxydes métalliques. Il se forme en traversant les couches de charbon de bois des bas fourneaux antiques et des hauts fourneaux communs à partir du quatorzième siècle. Les métallurgistes, et en particulier les sidérurgistes de l'Antiquité ou du Moyen âge, soupçonnent l'existence d'un corps subtil qui réduit les minerais finement triés et concassés.
Réduction du CO par le dihydrogène H
Suivant les catalyseurs employés, les stœchiométries et les conditions des phases gazeuses, une gamme de molécules organiques ou, en présence de métaux réactifs, de carbures métalliques a été obtenue au tournant du vingtième siècle. Les chimistes allemands et français ont été les précurseurs.
Senderens et Sabatier en 1902 proposent le nickel à 240 °C sous 1 atm.
Si on augmente la pression au delà de 100 atm et si on adapte la catalyse, la synthèse de combustibles liquides, sous forme d'hydrocarbures, ou encore d'alcènes, d'alcools, de glycols ou de cétones est réalisable.
La synthèse du méthanol, une des plus importantes matières premières industrielles de synthèse, illustre ce type de procédé :
A une pression d'environ 300 atm, T = 370 °C, l'emploi de catalyseurs à base de ZnO, CrO permet d'obtenir un méthanol très pur.
Un autre possibilité de catalyse à P # 50 bars, T = 250 °C avec CuO, ZnO, Al O est encore commune pour obtenir un méthanol.
On peut produire de l'acide acétique en faisant réagir du monoxyde de carbone et du méthanol avec une catalyse homogène de rhodium (procédé Monsanto).
Réaction d'addition
L'addition du CO en présence d'hydrogène avec les alcènes, appelée hydroformylation, permet la synthèse industrielle des aldéhydes.
L'action catalytique de Co(CO), à P # 120 bars, T = 80 °C, permet de fixer CO sur la chaîne carbonée. Les proportions de racémiques sont fonction de la facilité d'accès au site électrophile. De façon prépondérante, la chaîne est allongée plutôt que ramifiée.
Une réaction conduite en présence d'eau donne des acides carboxyliques. S'ils sont produits en même temps que des cétones, réduites en alcools, des équilibres d'estérification favorisent un mélange complexe avec des esters.
Le procédé Aldox permet à partir de l'alpha-oléfine, propène, et de gaz de synthèse une première réaction OXO. Après aldolisation avec la soude NaOH, puis une crotonisation à l'aide d'un acide, et enfin une hydrogénation sur Ni, des alcools primaires en C6-C9 peuvent servir de plastifiants sous forme d'ester.
Outre les alcènes ou oléfines, CO s'additionne aussi à l'oxygène (combustion), au halogène ou au cyanogène, au soufre ou à la soude.
Composés d'addition avec des métaux de transition : les métaux carbonyles
Avec le nickel Ni et le fer Fe, comme avec les autres métaux de transition du groupe VI, VII et VIII, le monoxyde de carbone forme des composés d'addition. La structure de ces complexes a été élucidée par les travaux pionniers d'Alfred Werner. Le monoxyde de nickel Ni(CO) est un composé volatile découvert en 1888 par Mond, Langer et Quincke qui a permis de purifier le nickel du Cobalt. Ce composé (cancérigène) se décompose immédiatement en monoxyde de carbone et nickel ce qui permet la purification du nickel. L'emploi de monoxyde de carbone sous forte pression a permis de découvrir une multitude d'autres métaux carbonyles entre 1890 et 1910, parmi lesquels le Co(CO) utilisé ci-dessous comme catalyseur de la synthèse OXO. Ces transporteurs d'oxyde de carbone sur les molécules organiques, communément usités dès 1940 et appelés carbonyles métalliques, donneront cours à une intense littérature de brevets dans les années 1950. Fernand Gallais a apporté une meilleure compréhension physico-chimique de ce domaine désormais établi de la chimie de coordinations.