Liaison chimique - Définition
La liste des auteurs de cet article est disponible ici.
Les liaisons chimiques fortes
Ces liaisons chimiques sont des forces intramoléculaires qui maintiennent les atomes ensemble dans les molécules et les solides. Ces liaisons peuvent être simples, doubles ou triples c'est-à-dire que le nombre d'électrons participants ( ou contenus dans l'orbitale de liaison) est de deux, quatre ou six. Un nombre pair d'électrons est habituel parce que les électrons appariés ont une énergie inférieure. En fait, des théories plus avancées sur les liaisons montrent que les liens ne sont pas toujours provoqués par un nombre entier d'électrons et, ce, dépendant de la distribution de ceux-ci dans chaque atome concerné dans la liaison. Par exemple, les carbones dans le benzène sont liés l'un à l'autre par environ 1,5 liaisons et les deux atomes dans l'oxyde nitrique NO sont connectés par environ 2,5 liaisons. Des liaisons quadruples ne sont pas impossibles mais sont très rares.
Le type de liaison dépend de la différence d'électronégativité et de la distribution des orbitales possibles dans les atomes liés. Plus l'électronégativité est importante, plus l'électron est attiré par un atome particulier et plus la liaison a un caractère ionique. Si l'électronégativité est faible, la liaison est covalente.
Liaison covalente
La liaison covalente est le type commun de liaison où la différence d'électronégativité entre les atomes liés est petite ou nulle. Dans ce dernier cas, on parle parfois de liaison purement covalente. Voir les articles Liaison σ et Liaison π pour l'explication CLOA habituelle des liaisons non-polaires.
Liaison covalente polaire
La liaison covalente polaire est par nature un type intermédiaire de liaison entre la liaison covalente et la liaison ionique. Dans des théories plus avancées, on considère que toutes les liaisons sont de ce type.
Liaisons ioniques
La liaison ionique est un type d'interaction électrostatique entre atomes dont la différence d'électronégativité est supérieure à 1,7 ( cette limite est conventionnelle). Avec une telle différence d'électronégativité, le transfert électronique est considéré comme total, l'atome le plus électronégatif devient un anion et le plus électropositif un cation. Il existe des ions polyatomiques qui portent une charge électrique et contiennent par ailleurs des liaisons covalentes entre les atomes les constituant. Les charges ioniques, en général, ont des valeurs entre -4e et +7e.
Liaison covalente coordinative
La liaison covalente coordinative est une liaison spéciale dans laquelle les électrons de liaison proviennent d'un seul des atomes, mais sont approximativement partagés également par les deux dans une orbitale. Cette configuration est différente d'une liaison ionique avec faible différence d'électronégativité.
Ions polyatomiques
Un type différent de liaisons entre deux ou plus d'atomes apparaissent dans les ions. La liaison est située au cœur des trois (ou plus) atomes.
Liaisons dans les formules chimiques
| longueur de liaisons en pm et énergies de liaison en kJ/mol. | ||
| Liaison | Longueur (pm) | Energie (kJ/mol) |
|---|---|---|
| H — Hydrogène | ||
| H–H | 74 | 436 |
| H–C | 109 | 413 |
| H–N | 101 | 391 |
| H–O | 96 | 366 |
| H–F | 92 | 568 |
| H–Cl | 127 | 432 |
| H–Br | 141 | 366 |
| C — Carbone | ||
| C–H | 109 | 413 |
| C–C | 154 | 348 |
| C=C | 134 | 614 |
| C≡C | 120 | 839 |
| C–N | 147 | 308 |
| C–O | 143 | 360 |
| C–F | 135 | 488 |
| C–Cl | 177 | 330 |
| C–Br | 194 | 288 |
| C–I | 214 | 216 |
| C–S | 182 | 272 |
| N — Azote | ||
| N–H | 101 | 391 |
| N–C | 147 | 308 |
| N–N | 145 | 170 |
| N≡N | 110 | 945 |
| O — Oxygène | ||
| O–H | 96 | 366 |
| O–C | 143 | 360 |
| O–O | 148 | 145 |
| O=O | 121 | 498 |
| F, Cl, Br, I — Halogènes | ||
| F–H | 92 | 568 |
| F–F | 142 | 158 |
| F–C | 135 | 488 |
| Cl–H | 127 | 432 |
| Cl–C | 177 | 330 |
| Cl–Cl | 199 | 243 |
| Br–H | 141 | 366 |
| Br–C | 194 | 288 |
| Br–Br | 228 | 193 |
| I–H | 161 | 298 |
| I–C | 214 | 216 |
| I–I | 267 | 151 |
| S — Soufre | ||
| C–S | 182 | 272 |
Comme les atomes, les molécules et leurs orbitales sont tridimensionnels, il est difficile d'utiliser des techniques simples pour les représenter. Dans les formules moléculaires, la liaison chimique (orbitale liante) entre deux atomes est indiquée de différentes manières selon les nécessités.
Parfois, elle est totalement ignorée. Par exemple, en chimie organique, les chimistes sont parfois intéressés par le groupe fonctionnel de la molécule. Ainsi, selon la nécessité, la formule moléculaire de l'éthanol peut être écrite sur le papier
- selon la configuration,
- en trois dimensions,
- en deux dimensions pleines (indiquant chaque liaison sans les directions tridimensionnelles),
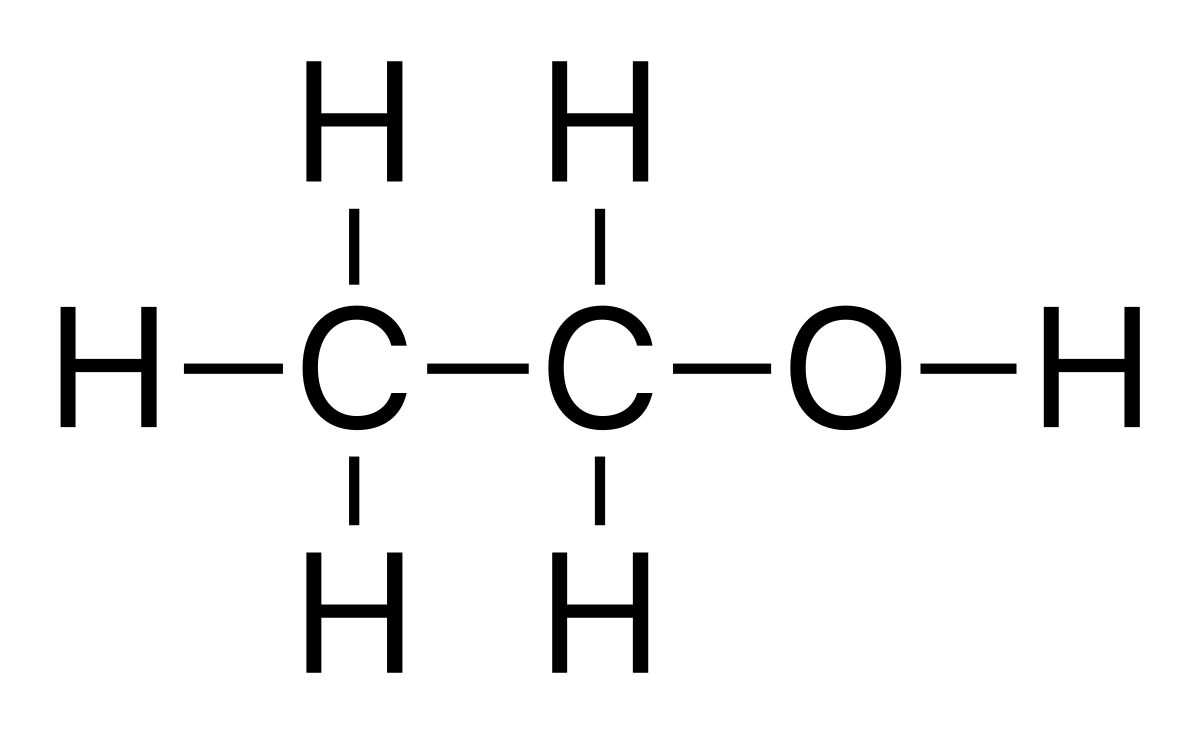
- en deux dimensions comprimées (CH3-CH2-OH),
- en séparant le groupe fonctionnel du reste de la molécule (C2H5OH), ou
- par constituants atomiques (C2H6O).
Parfois, même le nuage d'électrons non-liant est indiqué. (avec les directions en 2 dimensions approximative. Par exemple le carbone élémentaire:: .'C.' Certains chimistes indiquent aussi les orbitales ; par exemple, l'hypothétique anion ethene-4 (\/C=C/\ -4) indiquant la possibilité de formation de liaison.

















































