Levure - Définition
La liste des auteurs de cet article est disponible ici.
Modes de multiplications
Les levures sont capables de se multiplier selon deux modes différents : le mode sexué et le mode asexué.
Les ascomycètes qui se reproduisent par un processus sexué dans un asque résultant de la transformation d'une cellule après méiose.
Les basidiomycètes qui réalisent une reproduction sexuée avec formation de basidiospores sur une baside.
Les deutéromycètes regroupent l'ensemble des levures ne présentant pas de mode connu de reproduction sexuée.
Pour la plupart des levures la multiplication asexuée (mitotique) est la forme majeure de multiplication. Il existe 2 types de division mitotique chez les levures : par bourgeonnement (cas des Saccharomyces), ou par scission (cas des Schizosaccharomyces).
Métabolisme et conditions de croissance
Processus énergétiques
Les deux principaux processus énergétiques connus chez les hétérotrophes sont la respiration et les fermentations. Pour leur développement ces levures ont besoin :
- De composés carbonés source de carbone et d'énergie.
- De composés azotés réduits sous forme d'ammonium ; quelques levures peuvent cependant utiliser des composés oxydés (comme les nitrates) ou organiques pour la synthèse de protéines et d'acides nucléiques.
- D'éléments minéraux variés, vitamines et facteurs de croissance qui varient selon les levures.
Toutes les levures sont capables de dégrader le glucose, le fructose et le mannose en présence d'oxygène, par un métabolisme oxydatif, conduisant à la formation de CO2 et H2O.
Respiration aérobie : C6H12O6 (glucose) + 6O2 → 6CO2 + 6H2O + énergie utilisable
Cette voie métabolique est très énergétique et permet aux cellules de subir une multiplication avec un rendement cellulaire élevé (le rendement étant défini par le quotient de la quantité de cellules fabriquées par le substrat sucré consommé) . En plus des sucres simples, certaines levures peuvent utiliser d'autres glucides (mono, di ou trisaccharides, voir des polysaccharides comme l'amidon) mais aussi des alcools, des acides ou des alcanes. D'une manière plus générale, elles ont une capacité hydrolytique bien moindre que les moisissures.
En plus du métabolisme oxydatif, certaines levures peuvent privilégier une dégradation des glucides par un métabolisme fermentatif qui conduit à la formation d'éthanol et de CO2 suivant la réaction :
Fermentation alcoolique : C6H12O6 (glucose) → 2CO2 + 2CH3CH2OH (éthanol) + énergie utilisable
En plus de ces composés majoritaires, des alcools supérieurs, des aldéhydes, des esters, des acides… sont formés en plus petites quantités et participent qualitativement de façon importante et complexe à la formation des flaveurs des boissons fermentées. Ce métabolisme est moins énergétique que le métabolisme oxydatif, et le rendement de la multiplication cellulaire en est affecté bien que la vitesse de croissance puisse être nettement plus rapide que dans le processus oxydatif. Ce processus fermentaire peut fonctionner en présence ou en absence partielle ou totale d'oxygène c'est-à-dire en anaérobiose. On évoquera, dans le paragraphe suivant, l'apparition d'un processus fermentaire en présence d'oxygène en excès, décrit comme l'effet Crabtree et très important dans l'industrie de production des levures de boulangerie .
Effet Crabtree
Introduction
Cet effet exprime une tendance au gaspillage du substrat carboné (glucose par exemple) quand ce substrat est présent en grandes quantités. Cet effet permet de comprendre dans quelles conditions l'une des deux voies métaboliques décrites ci-dessus va être choisie. Mais avant de poursuivre la description de l'effet Crabtree il nous faut introduire des données indispensables à sa compréhension.
Éléments de cinétique de croissance microbienne :
La croissance des levures et bactéries dont les cellules filles se séparent des cellules mères (la population est ainsi toujours constituée de cellules individuelles ) suit une loi exponentielle dès lors que les conditions nutritives, l'aération et l'homogénéisation sont optimales. Un modèle simple a été proposé par Jacques Monod pour représenter cette croissance particulière.
La population évolue à partir d'une population faible X vers une population X selon l'équation suivante :
(1) X = X*e(μ*t)
où e est la base des Log Népérien (2,71) t est le temps et μ est défini comme le taux de croissance népérien du microorganisme. La valeur de ce taux de croissance μ est influencée par de multiples facteurs (température, pH, oxygénation, →concentrations des divers substrats indispensables à la fabrication des cellules etc..) qui retentissent sur l'activité des enzymes dont la cellule dispose afin d'assurer sa multiplication. Chacun des enzymes suit les lois décrites pour le fonctionnement général des enzymes (loi de Michaelis-Menten) et Jacques Monod a considéré empiriquement que la valeur du taux de croissance pour un substrat donné, en l'occurrence pour un sucre comme le glucose(1) suivait la loi de Michaélis-Menten et que
(2)
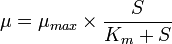
(S) la concentration en substrat dans le milieu de culture,
K représentant la concentration en substrat qui détermine μ = μ/2.
La pratique de certains types de culture des unicellulaires, (culture en continu ou en semi-continu ) a permis de préciser que le K de la levure pour le substrat glucose était de l'ordre de 50 mg/litre à 80 voire 100 mg/litre de milieu de culture.
(1)(l'hypothèse peut être étendue aux autres substrats indispensables à la croissance comme l'Azote ou le Phosphore etc..)
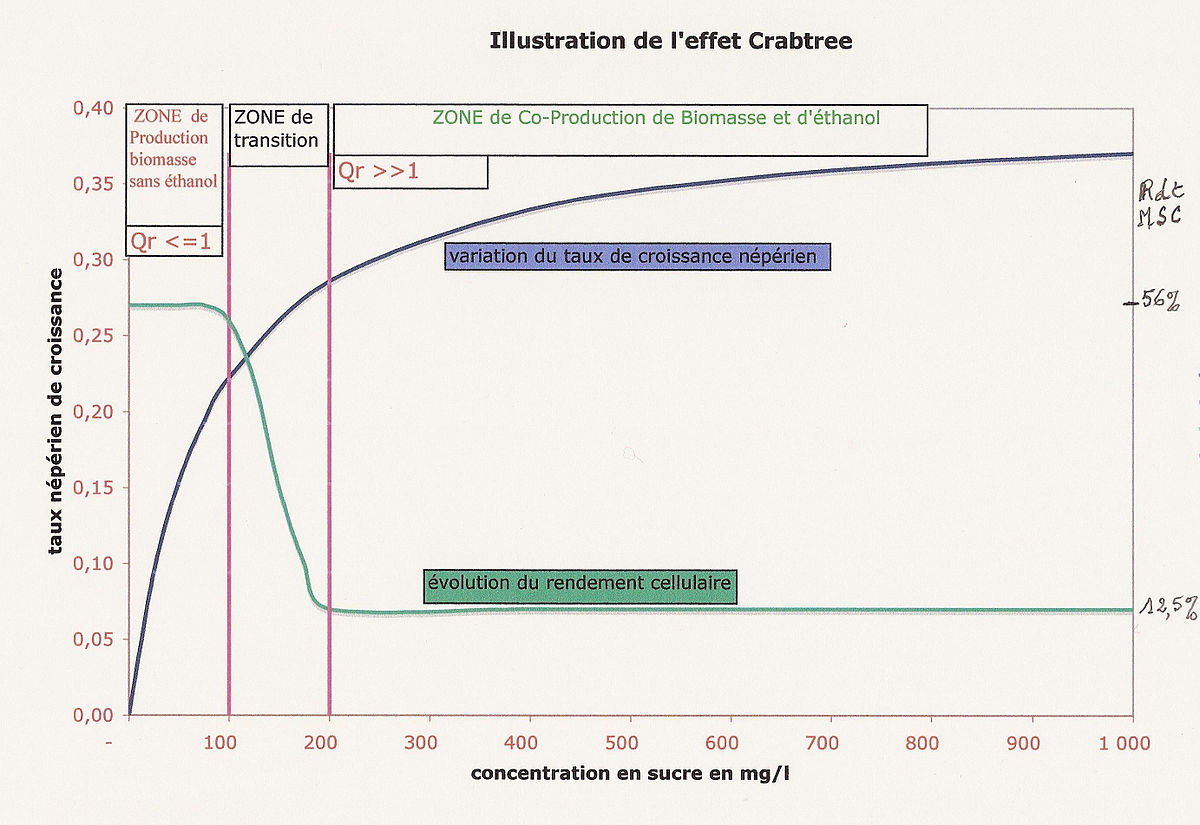
Illustration de cet effet
La courbe tracée en bleu est la représentation des variations du taux de croissance en fonction de la concentration en substrat et elle illustre l'équation (2) ci dessus. On rappelle que les conditions nutritives du milieu, ainsi que l'aération et l'homogénéisation du milieu sont en excès par rapport aux besoins de la levure; seules les concentrations en substrat sucré sont limitantes pour la levure.
- en ordonnées rouges à gauche : le taux de croissance népérien de la levure tel que décrit précédemment ;
- en ordonnées noires à droite : le rendement cellulaire exprimé en matière sèche par gramme de substrat consommé ;
- en abscisses les concentrations en sucre exprimées en mg/litre de culture.
On constate que le taux népérien maximum de croissance de la levure est de l'ordre de 0.4, ce taux correspondant à un temps de division cellulaire de 1 heure 45 minutes
Quand la concentration en substrat est voisine de 100 mg/litre, le taux de croissance est de 0.25 (correspondant à un temps de division cellulaire de 2 Heures et 20 minutes) : dans ces conditions le métabolisme est encore presque totalement oxydatif mais en se déplaçant vers la droite du graphique il devient de plus en plus fermentatif même en présence d'oxygène en excès. On doit noter que le temps de division cellulaire plus court implique un rendement cellulaire nettement moindre (courbe tracée en vert) ! Le rendement cellulaire s'abaisse en effet vers 12% c'est-à-dire qu'on fabrique 12 mg de cellules pour 100 mg de sucre consommés alors que dans la partie ascendante de la courbe illustrant les variations du taux de croissance le rendement cellulaire est nettement plus élevé et 55 mg de cellules sont fabriquées avec toujours 100 mg de sucre.L'explication de ce qui peut apparaître comma paradoxal réside dans la production simultanée de levure et d'éthanol quand la teneur en sucre dépasse un certain niveau.
Quotient respiratoire(Qr) = CO2produit / O2consommé
Rendement cellulaire = biomasse formée (mg) / masse substrat consommée (mg)
Conditions de croissance
- La température : La température optimale de culture des levures se situe en général entre 25 °C et 30 °C, mais comme les autres micro-organismes, les levures peuvent être classées en levures psychrophiles, mésophiles et thermophiles. D'une façon générale, les levures ne sont pas thermorésistantes. La destruction cellulaire commence dès 52 °C (contre 120 °C pour les bactéries thermophiles hors archées). Les levures sont aussi sensibles à la congélation et à la lyophilisation avec une grande variabilité selon les genres et espèces, et selon la phase de croissance (les cellules en phase exponentielle résistent moins que les cellules en phase stationnaire).
- Activité de l'eau : La plupart des souches ne peuvent se développer pour une activité de l'eau inférieure à 0,90 ; mais certaines tolèrent des pressions osmotiques plus élevées, correspondant à une activité de l'ordre de 0.60, en ralentissant leur métabolisme ; ces levures sont dites xérotolérantes.
- L'oxygène : toutes les levures sont capables de se développer en présence d'oxygène : il n'y a pas de levure anaérobie stricte. Certaines levures sont aérobie strictes (comme les Rhodotorula). Les autres sont aéro-anaérobie facultatives avec parmi elles : des levures préférant un métabolisme soit fermentaire soit respiratoire même en présence d'oxygène.
- Le pH : Les enveloppes cellulaires sont imperméables aux ions H3O+ et OH-. Les levures tolèrent donc des gammes de pH très larges, théoriquement de 2,4 à 8,6.
- La sensibilité aux agents chimiques :
- Les acides organiques : ils ont un effet inhibiteur sous leur forme dissociée car ils peuvent pénétrer dans la cellule et la sensibilité de la levure dépend de sa capacité à les métaboliser. C'est pour cette raison que les acides sorbiques et propioniques sont plus inhibiteurs que les acides acétique, citrique et lactique.
- L'éthanol : Les plus résistantes sont les Saccharomyces bayanus que l'on utilise dans les procédés de fermentation alcoolique pour l'élaboration des boissons ou d'éthanol industriel.
- Le sulfite : Le SO2 a un effet inhibiteur plus prononcé sur les bactéries que sur les levures, même si parmi les levures des sensibilités existent.
- Les Antibiotiques : le sensibilité à la cycloheximide (actidione) est variable et on peut distinguer 3 groupes de levures :
- Levures inhibées dès 1 µg/mL (ex : Saccharomyces)
- Levures inhibées à 25 µg/mL (ex: Schizosaccharomyces)
- Levures tolérantes à 1 mg/mL (ex: Zygosaccharomyces)
Le Chloramphénicol inhibe la synthèse de protéines mitochondriales mais pas celle des protéines cytoplasmiques. Seules les levures capables de fermenter peuvent alors cultiver en présence de chloramphénicol.