Leishmaniose viscérale - Définition
La liste des auteurs de cet article est disponible ici.
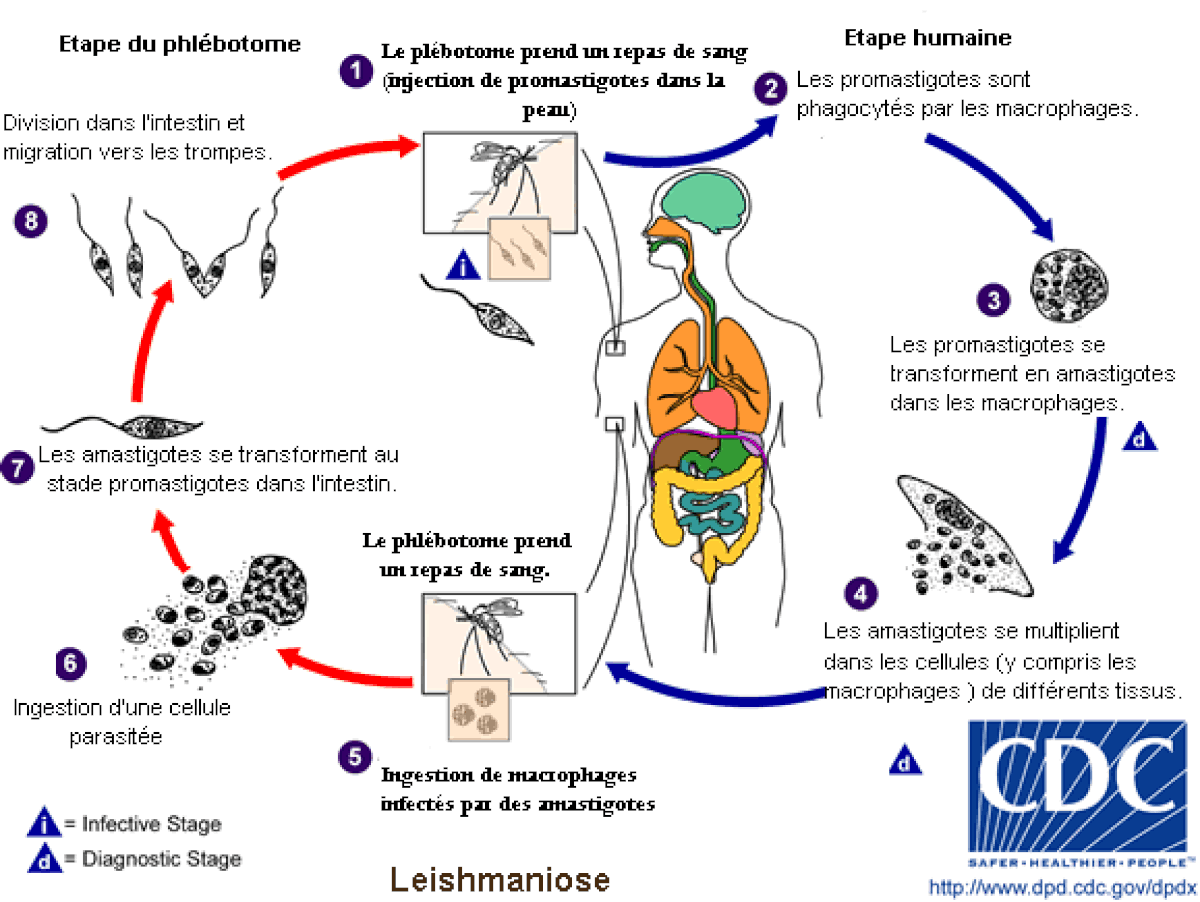
Cycle parasitaire
Le Kala-azar est transmis par un insecte vecteur, le phlébotome du genre phlébotome dans l’ancien monde et le genre de Lutzomyia dans le Nouveau Monde. Ce sont des créatures minuscules, 2 ou 3 millimètres de long, que l'on trouve dans les régions tropicales ou tempérées du monde entier. Les larves de phlébotome se développent dans la matière organique chaude et humide, aussi les vieux troncs d’arbres, les murs de maison ou les ordures sont leurs terrains de prédilection multipliant les réservoirs ce qui les rend plus difficile à éradiquer.
Le phlébotome femelle adulte est un suceur de sang, qui s’alimente habituellement la nuit sur sa proie ensommeillée. Quand la mouche pique un homme atteint de L. donovani, le germe pathogène est ingéré avec le sang de la proie. À ce moment le protozoaire se présente sous la plus petite de ses deux formes, appelé amastigote, non mobile, ronde, de seulement trois à sept micromètres de diamètre.
Dans l'estomac du phlébotome, les amastigotes se transforment rapidement en une deuxième forme du L. donovani appelé le promastigote. Cette forme est fusiforme, sa taille est triple de celle de l'amastigote, et elle possède un simple flagelle qui lui permet d’être mobile. Les promastigotes vivent à l’extérieur des cellules dans le tube digestif du phlébotome pendant quelques jours, se reproduisent par voie asexuée puis migrent vers les glandes salivaires.
C'est pour eux un moyen d’être transmis de nouveau à un mammifère hôte, car la mouche injecte sa salive dans la proie quand elle pique. Les promastigotes sont injectés dans la circulation sanguine de la proie avec la salive de la mouche.
Une fois à l'intérieur de leur nouvel hôte, chaque promastigote s'accroche à un macrophage à l'aide de ses flagelles. Il est alors capturé vivant par la cellule sous l’action de phagocytose du macrophage. Une fois à l'intérieur, il se transforme à nouveau dans la forme la plus petite l'amastigote. Comme amastigote, L.donovani peut seulement se reproduire à l’intérieur d’une cellule et les amastigotes se multiplient dans la partie la plus hostile du macrophage, à l'intérieur des organites phagolysosome, dont ils peuvent empêcher la réponse défensive normale. Lorsqu’ils se sont reproduits jusqu’à un certain niveau, L.donovani détruit la cellule hôte sous l’effet de pression de la masse des parasites, mais il existe une hypothèse récente, selon laquelle ils peuvent quitter la cellule en déclenchant la réponse d'exocytose du macrophage.
Les cellules filles des protozoaires migrent alors par la circulation sanguine pour trouver de nouveaux macrophages hôtes. À ce moment, L.donovani provoque une infection systémique et s’étend à tous les organes de l’hôte, en particulier à la rate et au foie.
Traitements
Comme avec beaucoup de maladies dans les pays en voie de développement, (y compris la trypanosomiase et la malaria) on manque douloureusement de médicaments efficaces et accessibles et le parasite ou les insectes vecteurs deviennent de plus en plus résistants aux molécules anti-parasitaires existantes. Vraisemblablement en raison du manque de rentabilité, les nouvelles thérapeutiques sont longues à émerger et une grande partie de la recherche fondamentale sur les cibles potentielles des molécules a lieu dans les universités, financées par des organismes caritatifs. Cela pourrait changer en raison de l'infection des membres des forces armées des nations « développées » telles que celles qui occupent actuellement des pays comme l’Afghanistan et l’Irak, où la Leishmaniose est fréquente.
Le traitement le plus courant est l’antimoine pentavalent le stibogluconate de sodium et l’antimoniate de méglumine. La résistance à ces médicaments est maintenant fréquente en Inde et le traitement de choix pour la leishmaniose viscérale acquise en Inde est maintenant l'Amphotéricine B dans ses diverses présentations (Ambisome®, Abelcet®, Amphocil®)
- AmBisome : dose totale 21 mg/kg (LV méditerranéen/brésilien); dose totale 7,5 mg/kg pendant 6 jours (LV indien)
- Amphocil : dose totale 7,5 mg/kg pendant 6 jours (LV indien) Une dose plus faible (0.5 à 1 mg/kg) est donnée le premier jour, augmentée jusqu’à 1 à 2 mg/kg le deuxième jour, puis 1.5 à 3 mg/kg le troisième et les jours suivants.
La Miltefosine Impavido® est le premier traitement par voie orale pour cette maladie. Le taux d’efficacité de la miltefosine dans des essais cliniques la phase III est de 95% ; Des études en Éthiopie montrent qu’il est également efficace en Afrique. Chez les malades immunodéprimés atteints du HIV qui sont co-infectés avec la leishmaniose il a été prouvé que même dans les cas de résistance 2/3 des patients ont réagi positivement à ce nouveau traitement. La Miltefosine a reçu l'autorisation de mise sur le marché des autorités indiennes en 2002 et Allemandes en 2004.Il est maintenant autorisé dans de nombreux pays. La molécule est généralement mieux tolérée que d'autres substances. Les effets secondaires principaux sont les troubles gastro-intestinaux les 1 à 2 premiers jours du traitement, sans conséquence sur l'efficacité thérapeutique. Puisqu'il est disponible pour un traitement par voie orale, les dépenses et les inconvénients de l'hospitalisation sont évités, ce qui fait de lui une alternative intéressante.
L'institut pour la santé mondiale a développé la paromomycine, qui serait aussi efficace et bon marché. Un traitement avec la paromomycine coûtera environ 10 dollars. À l'origine la molécule avait été découverte dans les années 1960, mais abandonnée parce qu'elle n’était pas rentable, la maladie affectant la plupart du temps des malades pauvres.