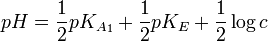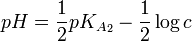Indicateur de pH - Définition
La liste des auteurs de cet article est disponible ici.
Applications
Titrages par indicateurs colorés
Les indicateurs changeant de couleur en fonction du pH, ils servent donc à repérer l’équivalence lors d’un titrage acido-basique. Considérons le titrage d’un acide AH par une base B ou de la base B par l’acide AH. La réaction acido-basique est la suivante :
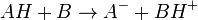
Elle résulte des deux demi-équations des couples AH/A- et BH+/B :
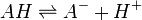
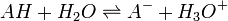
![K_{A_{AH/A^-}}=K_{A_1}= \frac{\left[ A^- \right] \left[ H_3O^+ \right]}{\left[AH\right]}](https://static.techno-science.net/illustration/Definitions/autres/6/6eaab961333273a04f82d01def62bb27_8281e2ef92fd6720a93d15c3c6bd29c8.png)
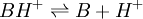
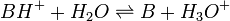
![K_{A_{AH/A^-}}=K_{A_1}= \frac{\left[ B \right] \left[ H_3O^+ \right]}{\left[BH^+\right]}](https://static.techno-science.net/illustration/Definitions/autres/6/6e7d70363d305711026e502323dffb4d_cf8b8226f5b7a3ce76c2c3c019b3cc52.png)
Par une étude analytique, on peut déterminer des relations entre le pH à l’équivalence, les concentrations des espèces mises en jeu et le pKA des couples.
| Type de titrage | Exemples de AH | Exemples de B | pH à l'équivalence |
|---|---|---|---|
| Acide faible de concentration c par base forte | RCOOH, HXO, NH4+ | HO-, NH2+ alcoolate… |
|
| Base faible de concentration c par acide fort | HX, HXO4, HNO3 | RCOO-, CO32-, NH3… |
|
| Acide fort par base forte ou base forte par acide fort | HX, HXO4, HNO3 | HO-, NH2+ alcoolate… | pH = 7 |
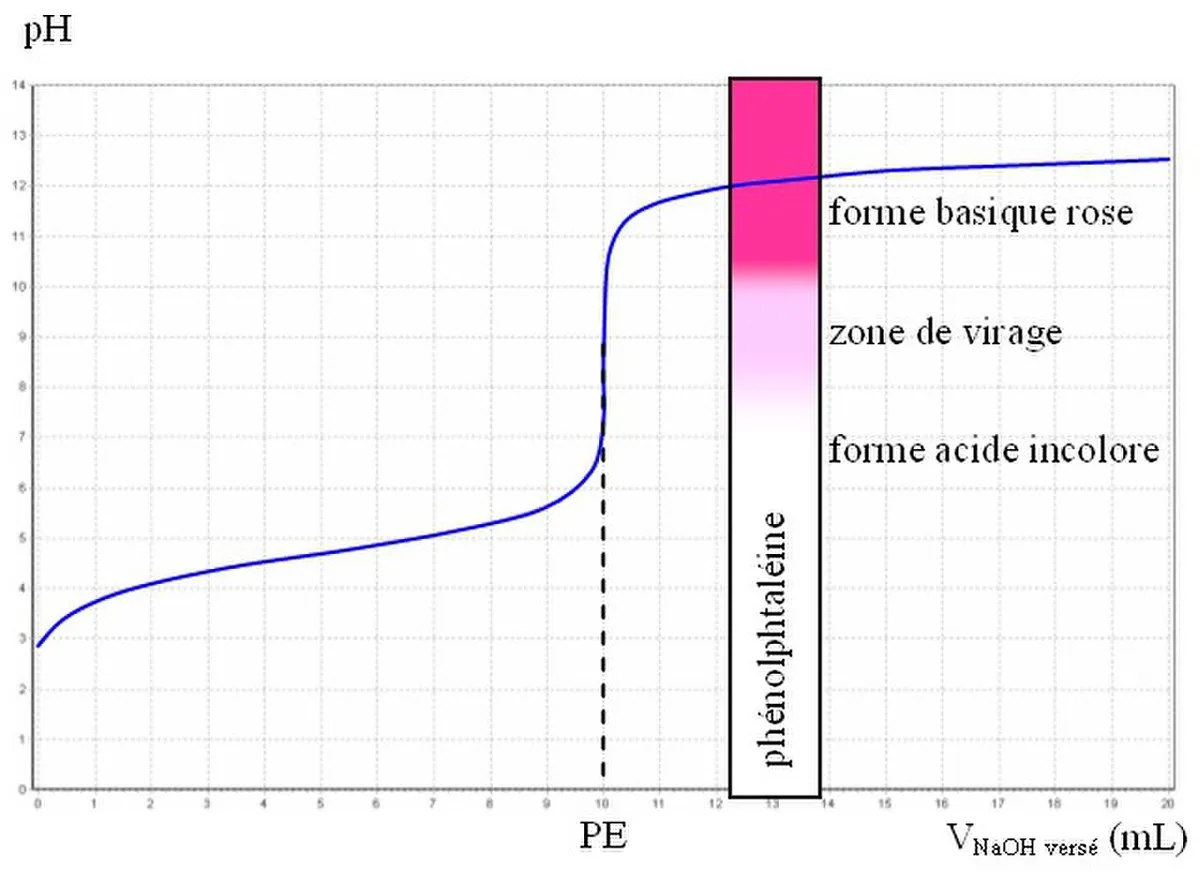
Une fois l’indicateur coloré adéquat choisi de manière à ce que sa zone de virage contienne le pH du point équivalent (P.E.), on peut donc réaliser un titrage par indicateur coloré.
- Exemple d’un titrage d’acide faible par de la soude (cas le plus courant)
Le pH du P.E. se situant aux alentours de 9, on utilise quelques gouttes de phénolphtaléine (virage 8,2-10), ajoutées dans le mélange réactionnel. L’équivalence se repère donc par le changement de couleur. La solution titrée est incolore dans la première partie de la manipulation. On ajoute progressivement de la soude et la solution passe au rose à l’équivalence, c’est-à-dire lorsque acide et base sont dans les proportions stœchiométriques.
Les indicateurs colorés doivent posséder une absorbance particulièrement grande, même présent en petite quantité (ce qui est le propre d'un indicateur). Ainsi, on peut les utiliser dans les titrages à une concentration pouvant descendre jusqu’à 10-6 M. On est donc certain, dans ces conditions, de pouvoir apercevoir le virage sans jamais influencer sur le pH de la solution, même si l’indicateur reste un couple acide-base. Quelques gouttes d’un indicateur peuvent finalement colorer des dizaines de mL de solution.
Colorants
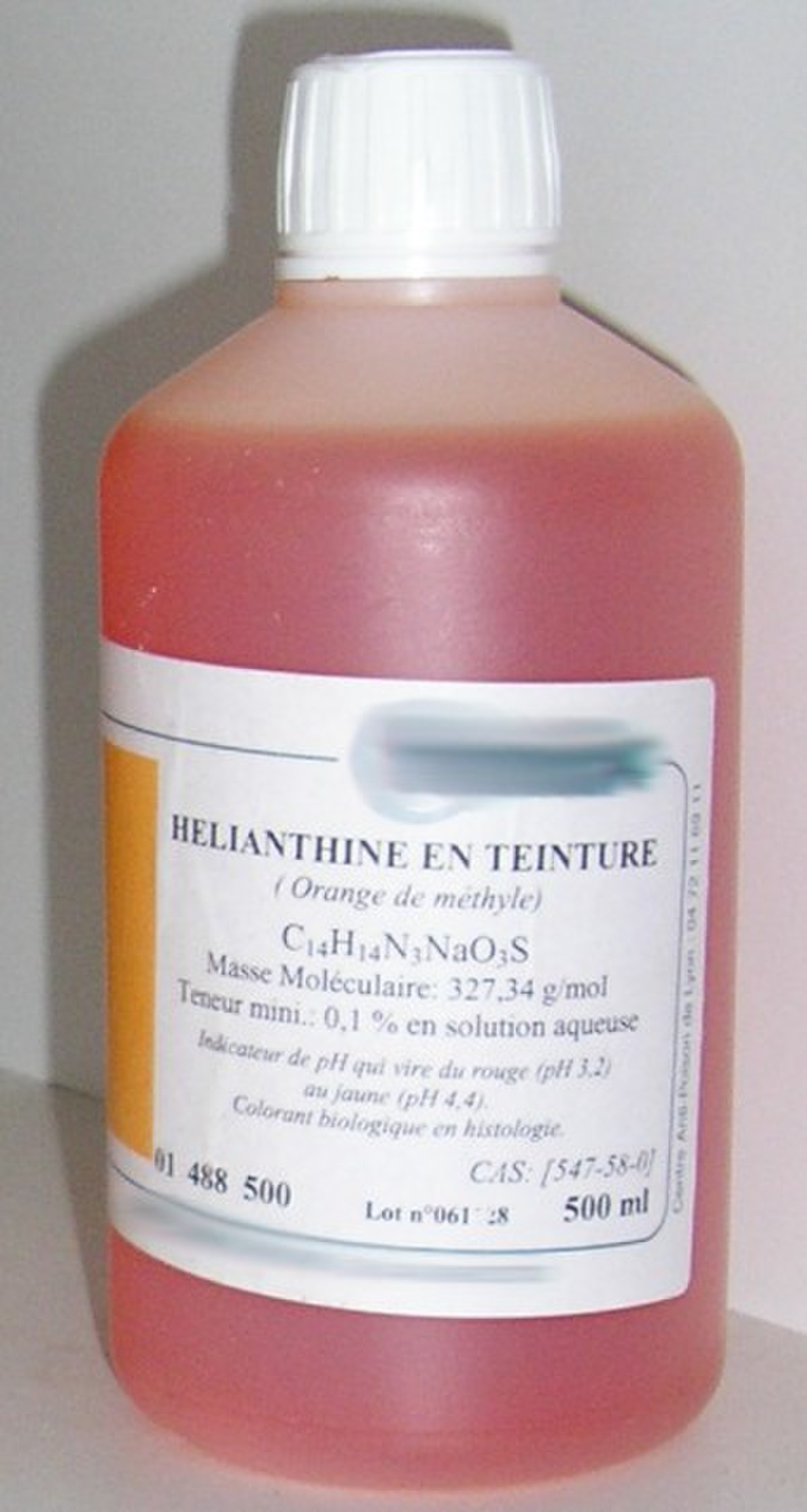
Quelques-uns des indicateurs les plus courants sont aussi utilisés en tant que colorants organiques (textiles notamment). On peut citer le bleu de bromothymol, qui peut être utilisé comme colorant bleu ou jaune, ou encore le vert de malachite, qui est utilisé comme colorant vert.
Chez la plupart des fournisseurs les indicateurs colorés sont par ailleurs vendus sous le nom explicite de teinture lorsqu'ils sont en solution (photo ci-contre).
Autres utilisations
- Les indicateurs colorés servent en chimie, outre leur utilisation pour les dosages, pour déterminer rapidement l'acidité ou la basicité d'un milieu. On préférera dans ce cas les utiliser sous la forme d'un .
- Le rouge de phénol peut être utilisé par tous pour tester le pH des piscines. Il est souvent vendu en petits flacons et est accompagné d'une échelle de teintes (zone de virage du jaune au rouge) permettant de déterminer qualitativement le pH de l'eau.
- Quelques indicateurs possèdent aussi des propriétés biologiques, c'est le cas du bleu de bromophénol.
Limites d'utilisations
Les indicateurs colorés doivent être utilisés en très faibles quantités dans les mesures de pH car ils restent des composés acides ou basiques risquant d'influencer sur le pH de la solution. C'est pour cela qu'ils doivent posséder une grande absorbance. Ils ne peuvent être utilisés dans des solutions destinées à la consommation, du fait de leur toxicité, et ce, malgré leur faible concentration. De leur côté, les possèdent souvent des zones de virage très larges qui empêche toute utilisation pour une mesure de pH précise ou un dosage.