Hydroxyde de baryum - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Hydroxyde de baryum | ||
|---|---|---|
| Général | ||
| No CAS | (anhydre) (·H2O) | |
| No EINECS | ||
| Apparence | solide blanc | |
| Propriétés chimiques | ||
| Formule brute | Ba(OH)2 monohydrate Ba(OH)2.H2O octahydrate Ba(OH)2.8H2O | |
| Masse molaire | 171,342 ± 0,008 g·mol-1 | |
| pKa | 14 | |
| Propriétés physiques | ||
| T° fusion | 681 K (408 °C) | |
| T° ébullition | 1053 K (780 °C) | |
| Masse volumique | 2,20×10³ kg/m³ (anhydre) 3,74×10³ kg/m³ (monohydrate) | |
| Thermochimie | ||
| S0 | ~100 J/mol·K | |
| ΔH0 | -945,5 kJ/mol | |
| Précautions | ||
| | ||
| ||
| | ||

| ||
| | ||
L'hydroxyde de baryum est un composé minéral de baryum et d'ions hydroxydes de formule chimique Ba(OH)2. C'est un solide blanc poudreux. Il existe sous deux formes hydratées, monohydrate (sa forme commerciale) et octahydrate.
Propriétés physico-chimiques
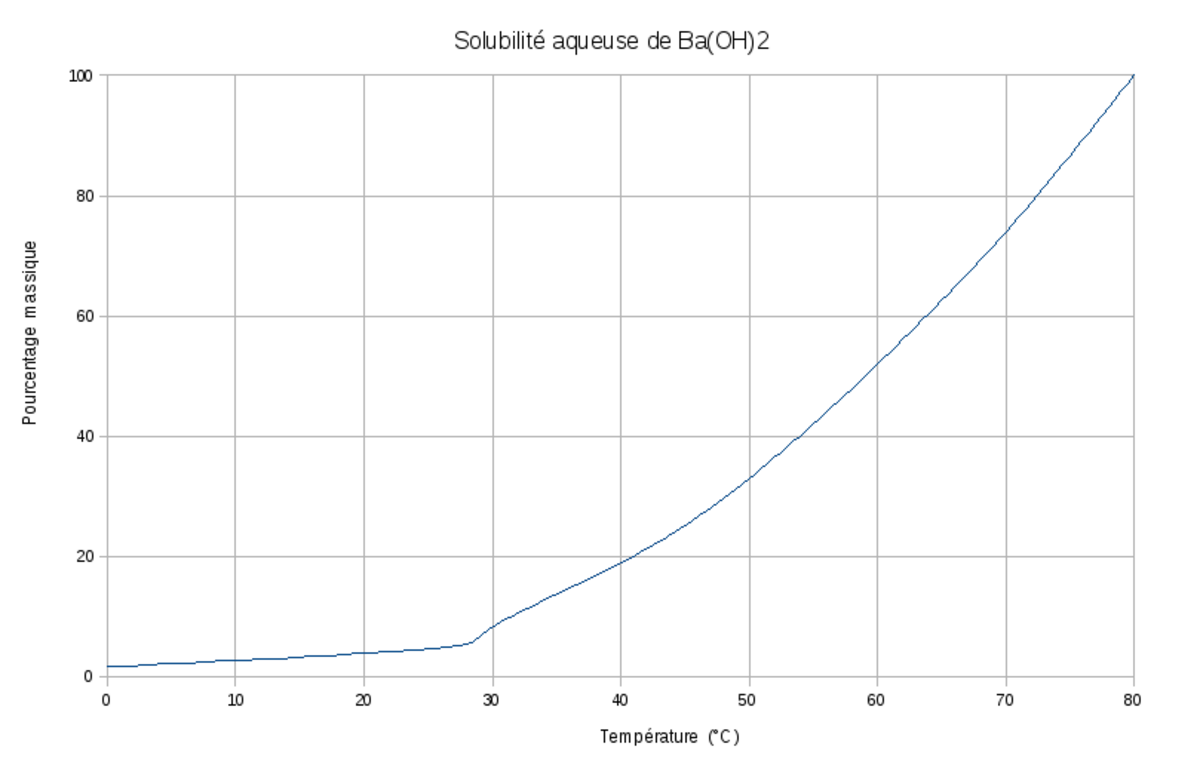
La solubilité dans l'eau de l'hydroxyde de baryum dépend fortement de la température. Elle augmente avec la température depuis 34 g·l-1 à 20 °C jusqu'à 910 g·l-1 à 80 °C. L'hydroxyde de baryum est donc presque totalement dissocié dans l'eau, et se comporte donc comme une base forte.
En présence de dioxyde de carbone, l'hydroxyde de baryum réagit pour former du carbonate de baryum, insoluble dans l'eau :
- Ba(OH)2 + CO2 → BaCO3solide + H2O
Utilisation
L'hydroxyde de baryum est utilisé en chimie analytique pour le titrage d'acides faibles, notamment d'acides organiques. En effet, l'utilisation d'une solution d'hydroxyde de baryum permet d'éviter complètement la présence d'ions carbonates, contrairement aux solutions d'hydroxyde de sodium ou d'hydroxyde de potassium, le carbonate de baryum étant insoluble dans l'eau. Cette propriété permet d'effectuer le titrage avec une meilleure précision du fait de l'absence d'ions carbonates faiblement basiques.
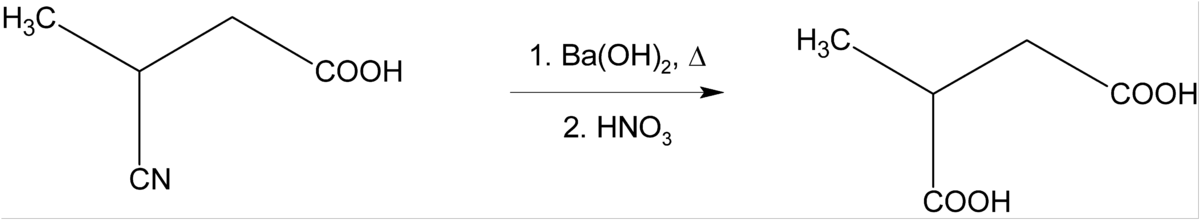
L'hydroxyde de baryum est également utilisé comme base forte en synthèse organique, par exemple pour l'hydrolyse des esters ou des nitriles.
Dans l'industrie, il est notamment utilisé pour la fabrication de verres et de céramiques.
Préparation
L'hydroxyde de baryum est un composé qui n'existe pas dans la nature. Il peut être préparé par dissolution dans l'eau de l'oxyde de baryum (BaO). Au cours de cette dissolution, un précipité apparaît, constitué d'hydroxyde de baryum octahydratée. ce dernier peut être converti en hydroxyde de baryum monohydraté par chauffage à l'air, ou en hydroxyde de baryum anhydre par chauffage dans le vide.
Il peut également être préparé à partir de sulfure de baryum par réaction avec l'eau :
- BaS + 2H2O → Ba(OH)2 + H2S
Sécurité et toxicité
L'hydroxyde de baryum est une base forte. Il est donc fortement corrosif. De plus, il est toxique, comme la plupart des composés du baryum.
Phrases de risque et conseils de prudence

- R: 20/21/22 (Nocif par inhalation, par contact avec la peau et par ingestion)
- R: 34 (Provoque des brûlures)
- S: 26 (En cas de contact avec les yeux, laver immédiatement consulter un ophtalmologiste)
- S: 36/37/39 (Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage)
- S: 45 (En cas d’accident ou de malaise consulter immédiatement un médecin et lui montrer l’emballage ou l’étiquette)