Hydrogénation - Définition
La liste des auteurs de cet article est disponible ici.
Applications
Chimie organique
Hydrogénation de liaisons multiples carbone-carbone
Une importante application de l'hydrogénation catalytique en chimie organique est l'hydrogénation de liaisons multiples (double ou triple) carbone-carbone. Cette technique est d'ailleurs utilisé dans l'industrie agroalimentaire, pour saturer les lipides insaturés afin de les rendre solides. On utilise pour cette hydrogénation en général du dihydrogène avec un catalyseur insoluble, comme le palladium, le platine, l'iridium, ou du nickel (nickel de Raney).
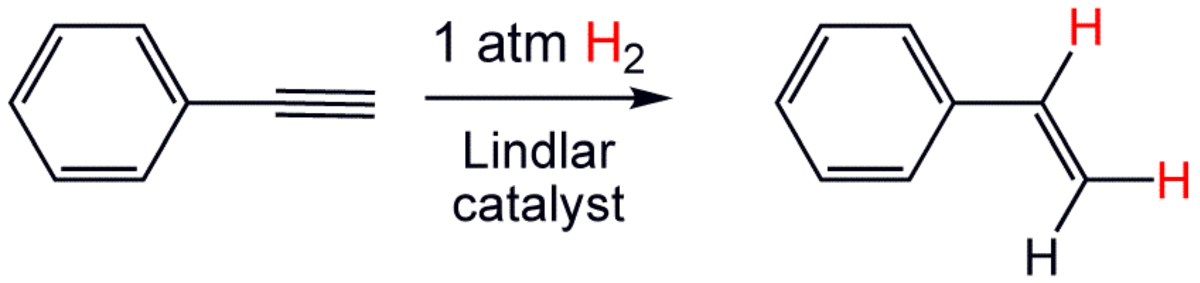
L'hydrogénation partielle de la triple liaisons des alcynes peut former deux composés, les isomères E ou Z de l'alcène correspondant. Le choix du catalyseur utilisé permet parfois d'obtenir préférentiellement l'un des deux stéréoisomère (par exemple le catalyseur de Lindlar donne préférentiellement l'isomère Z, quand le sodium+ammoniac donne plutôt l'isomère E).
Cependant, dans les conditions de l'hydrogénation, les alcènes sont bien souvent rapidement eux-mêmes hydrogénés en alcane; en utilisant des catalyseurs spéciaux, mins réactifs, comme le catalyseur de Lindlar, on peut arrêter l'hydrogénation au stade alcène.
L'encombrement stérique joue un rôle dans la facilité de l'hydrogénation catalytiques des alcènes, et permet soit de faire cette réaction à pression et température « normales », soit oblige à des conditions plus drastiques. Ainsi un alcène monosubstitué sera facilement hydrogéné, alors qu'un alcène portant de nombreux substituants sera difficile à hydrogéner.
L'hydrogénation peut aussi être une mesure de stabilité des composés insaturés. Par exemple en observant l'hydrogénation du cyclohexène et celle du cyclohexa-1,3-diène, on peut extrapoler pour déduire la réaction du cyclohaxatriène théorique (avec liaisons doubles localisées) et ainsi comparer sa stabilité avec le benzène, ce qui permet de mesurer l'effet stabilisant produit par la délocalisation des liaisons doubles dans un composé aromatique.
Hydrogénation d'autres liaisons multiples
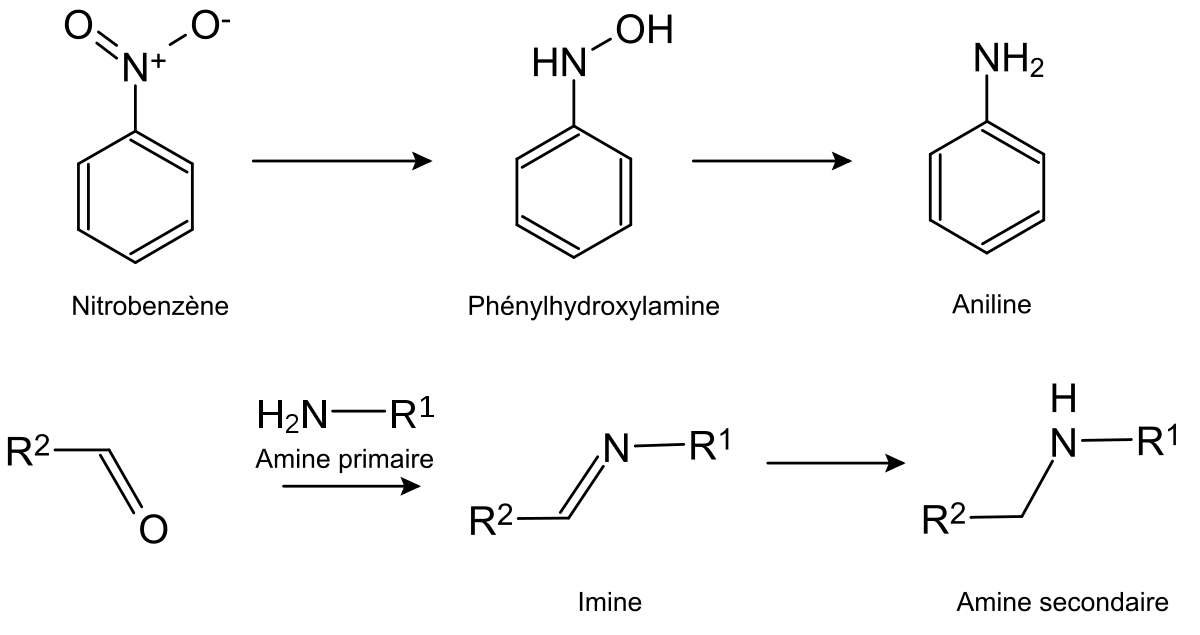
Il est également possible de réduire par hydrogénation des liaisons multiples carbone-hétéroatome ou hétéroatome-hétéroatome. Il est en particulier possible de réduire les groupe nitro, imines et oximes.
Le Procédé Haber est par exemple de procédé à grande échelle effectuant l'hydrogénation du diazote pour produire de l'ammoniac :
Le dioxygène peut aussi être partiellement hydrogéné en peroxyde d'hydrogène, cependant ce procédé est peu développé.
Déprotection par hydrogénation
En synthèse organique, il est courant de protéger certains groupes fonctionnels, sensibles à des réactions destinées à d'autre partie de la molécule, portection qu'on retire une fois la ou les réactions sensibles effectuées.
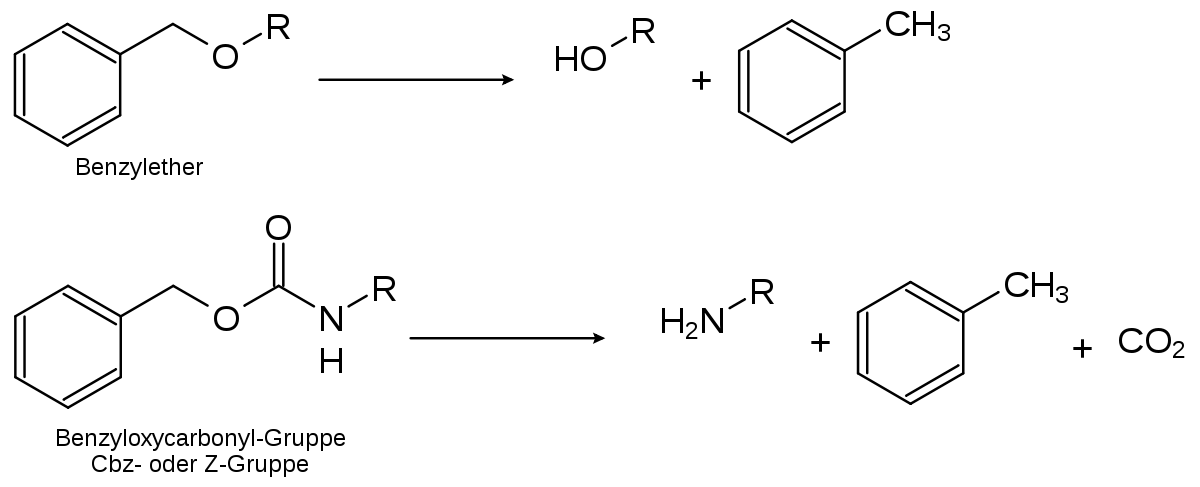
En raison des conditions douces dans laquelle elle s'effectue, l'hydrogénation catalytique est un moyen efficace pour et adapté pour supprimer une protection sur un groupe. Elle est en particulier utilisée pour retirer les groupes protecteur des groupes benzyles, comme les éthers de benzyle ou les esters et dérivés d'esters de benzyle.
Industrie
L'hydrogénation a de nombreuses applications industrielles. On peut notamment citer le procédé Haber, processus d'hydrogénation du diazote en ammoniac, ou encore le procédé Bergius pour fabriquer de l'essence de synthèse à partir du charbon.
L'hydrogénation est aussi utilisé dans l'industrié pétrochimique, pour convertir les alcènes en alcanes, moins volatils, et les composés aromatiques en alcanes saturés (paraffines) et en cycloalcanes (naphtènes). On peut aussi citer l'hydrocraquage de résidus lourds en gazole.
Le xylitol, un polyol, est produit par hydrogénation du xylose, un aldose.