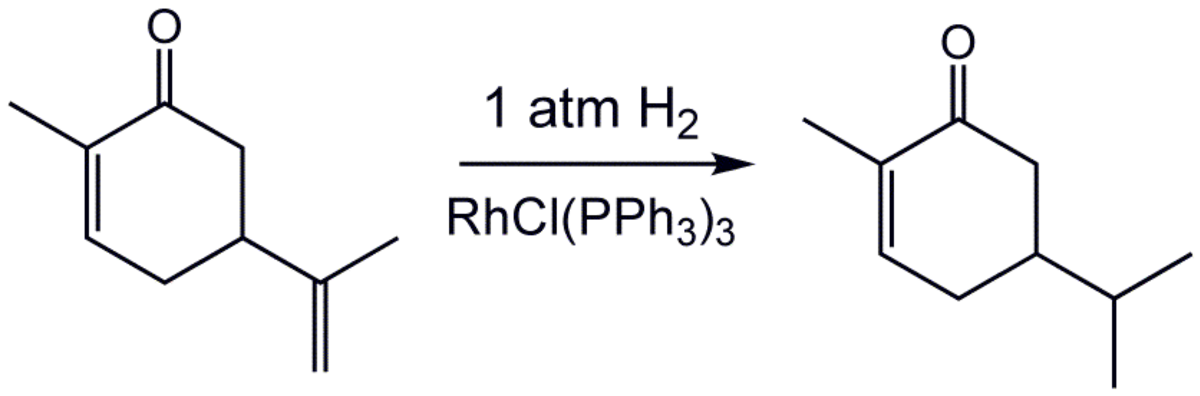Hydrogénation - Définition
La liste des auteurs de cet article est disponible ici.
Mécanisme
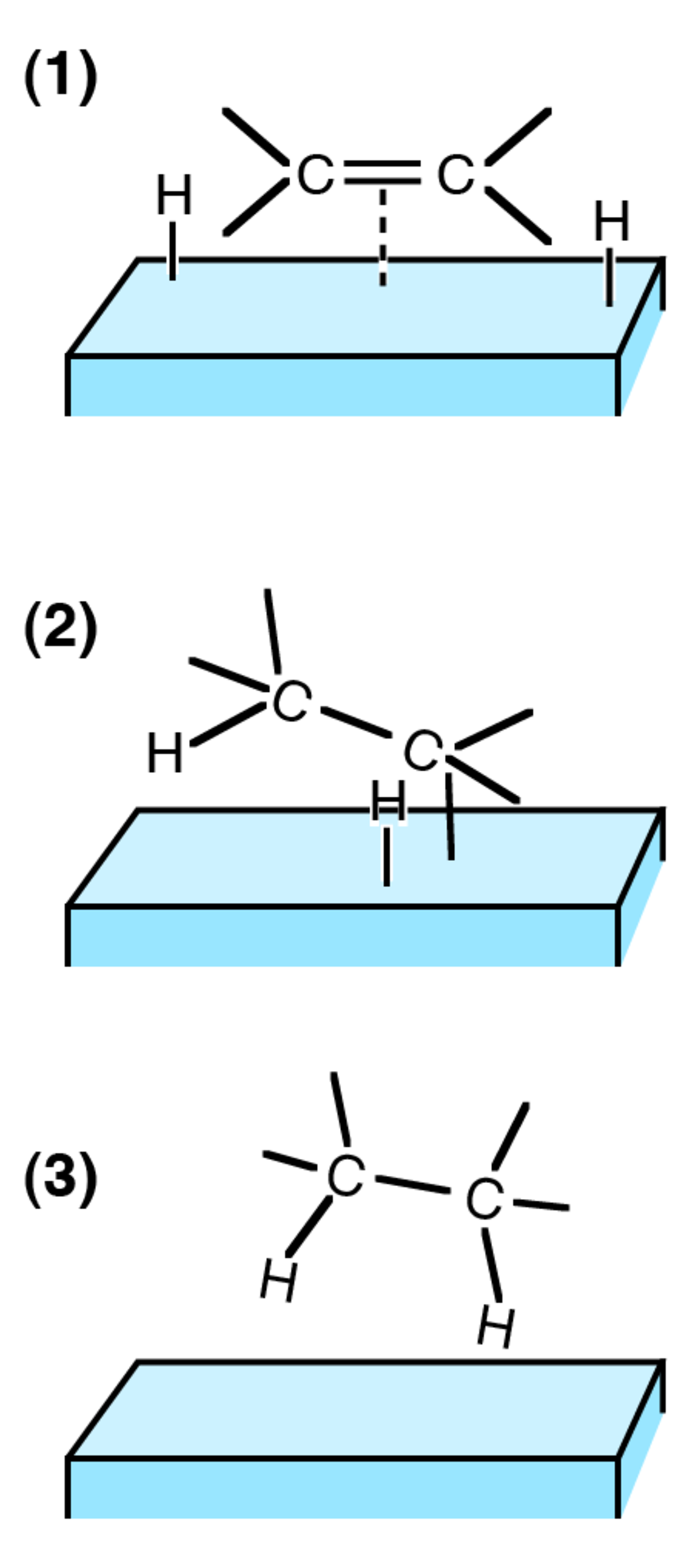
Les mécanismes en catalyse hétérogène et dans la plupart des cas en catalyse homogène sont relativement similaires. Le catalyseur (métal) se lie à une molécule de dihydrogène, puis au composé à la liaison multiple, et transfert un à un les atomes d'hydrogène. De par ce mécanisme, les atomes d'hydrogènes se retrouvent ajoutés du même côté de la liaison multiple, la réaction est donc une addition syn.
Catalyse hétérogène
Chaque atome de la molécule de dihydrogène se lie au catalyseur (en général un métal), rendant la liaison entre les deux atomes plus fragile, faisant supporter à chaque atome un déficit en électron, et les rendant ainsi réactif vis-à-vis d'une liaison multiple riche en électrons. Un atome d'hydrogène est additionné à la double liaison (cette étape étant réversible) puis l'autre (cette étape étant alors irréversible dans les conditions de l'hydrogénation.
Catalyse homogène
Dans la plupart des hydrogénations par catalyse homogène, le métal se lie au composé et au dihydrogène pour former un intermédiaire qui est un complexe composé-métal-(H)2. On suppose que la séquence générale des réactions est celle décrite ci-dessous, ou du moins en est très proche (on prend ici pour exemple de composé un alcène) :
- Liaison entre le catalyseur métallique et le dihydrogène pour former un complexe dihydride (« addition oxydante »), avec au préalable formation d'un complexe dihydrogène :
- LnM + H2 → LnMH2
- Liaison avec l'alcène:
- LnM(H2) + CH2=CHR → Ln-1MH2(CH2=CHR) + L
- Transfert de l'un des atomes d'hydrogène du métal au carbone (« insertion migratoire »)
- Ln-1MH2(CH2=CHR) → Ln-1M(H)(CH2-CH2R)
- Transfert du second atome d'hydrogène du métal au groupe alkyle avec dissociation simultanée de l'alcane (« élimination réductrice »)
- Ln-1M(H)(CH2-CH2R) → Ln-1M + CH3-CH2R
Réaction
Les réactions d'hydrogénation sont en général très favorables thermodynamiquement. Par exemple, pour la réaction d'hydrogénation d'un alcène, l'éthylène (C2H4 + H2 → C2H6), si la baisse du facteur entropique (ΔrS°=-120,9 J.K−1.mol−1) défavorise la réaction, une forte exothermicité (ΔrH°=-136,95 kJ.mol−1) la compense largement pour obtenir à température ambiante une enthalpie libre de réaction très négative (ΔrG°=-100,92 kJ.mol−1). Cependant cette réaction, en raison de la grande stabilité de la molécule de dihydrogène (ΔH°diss (H2) = 434 kJ.mol−1), nécessite soit une grande quantité d'énergie (haute température) soit une catalyse. En règle générale, la deuxième solution est presque toujours préférée, ainsi, la réaction démarre en présence de trois espèces : le réactif insaturé à hydrogéner, la source d'hydrogène (H2 le plus souvent) et le catalyseur.
Réactifs
Les composé susceptibles d'être hydrogénés sont les composés chimiques possédant une ou plusieurs liaisons multiples. Dans certains cas, en particulier pour les composés possédant une liaison triple, le produit final dépend également des conditions de l'hydrogénation. Par exemple, dans le cas des alcynes, si ceux-ci sont hydrogénés de façon douce, ils donneront des alcènes alors que dans des conditions plus rudes, ils donneront directement les alcanes correspondants.
| alcène, R2C=CR'2 | alcane, R2CHCHR'2 |
| alcyne , RCCR | alcène, cis-RHC=CHR' ou alcane, R2CHCHR'2 |
| aldéhyde, RCHO | alcool primaire, RCH2OH |
| cétone, R2CO | alcool secondaire, R2CHOH |
| ester, RCO2R' | deux alcools, RCH2OH, R'OH |
| imine, RR'CNR" | amine, RR'CHNHR" |
| amide, RC(O)NR'2 | amine, RCH2NR'2 |
| nitrile, RCN | imine, RHCNH |
| nitro, RNO2 | amine, RNH2 |
Source en hydrogène
La source d'hydrogène la plus commune est évidemment le dihydrogène gazeux, H2, généralement conservé en cylindre pressurisé. La réaction d'hydrogénation nécessite d'ailleurs fréquemment une pression en dihydrogène supérieure à 1 atmosphère. Le dihydrogène gazeux est produit industriellement par reformage d'hydrocarbures.
L'hydrogène peut aussi, dans certaines applications spécialisées, être extrait (on parle de « transfert ») de « donneurs en hydrogène » qui sont souvent des solvants comme l'hydrazine, le dihydronaphtalène, le dihydroanthracène, l'isopropanol, l'acide méthanoïque, ou encore le cyclohexadiène. En synthèse organique, l'hydrogénation par transfert est utile pour la réduction de composés insaturés polaires comme les cétones, les aldéhydes ou les imines.
Catalyseurs

Comme expliqué plus haut, si la réaction est favorable thermodynamiquement, elle est difficile à démarrer de par la grande stabilité du dihydrogène. Ainsi, sauf exception, aucune réaction ne se produit entre le dihydrogène H2 et le composé organique à une température inférieure à 480 °C et en l'absence de catalyseur. D'une part chauffer le milieu réactionnel à haute température est peu pratique (quoi que faisable), et d'autre part certains composés organiques ne peuvent supporter une température élevée. La solution privilégiée consiste donc à utiliser un catalyseur. Ce catalyseur va se lier à la fois au dihydrogène et au composé insaturé, et ainsi les « aider » à réagir ensemble.
Les métaux du groupe du platine, en particulier le platine, le palladium, le rhodium et le ruthénium sont des catalyseurs particulièrement actifs, et qui agissent à basse température et faible pression en H2.
Des catalyseurs à partir de métaux non précieux ont été développés, en particulier à base de nickel (comme la nickel de Raney ou le nickel d'Urushibara) comme alternative plus économique, mais ceux-ci sont généralement plus lents ou requièrent des températures plus hautes et une pression en dihydrogène plus importante (en particulier le nickel de Raney). Un compromis est donc nécessaire entre la réactivité du catalyseur (donc la vitesse de réaction) et le prix de celui-ci, mais aussi le prix de l'équipement pour travailler à haute pression. Il existe aussi des catalyseurs à base de cobalt, de fer, et de chromite de cuivre ou de zinc.
Les catalyseurs sont classés en deux grandes familles :
- les catalyseurs qui se dissolvent dans le solvant où se trouve le composé insaturé à hydrogéner ; on parle alors de catalyseur homogène.
- les catalyseurs qui restent des solides en suspension dans le solvant qui contient le composé insaturé à hydrogéner, ou les catalyseurs (solides) utilisés pour des réaction en phase gazeuse (réactifs gazeux) ; on parle alors de catalyseur hétérogène.
Poison de catalyseur
On appelle poison de catalyseur toute substance qui réagit avec un site actif de la surface d'un catalyseur, et qui bloque son action partiellement ou totalement. De telles substances peuvent être responsables de l'échec d'une hydrogénation catalytique, mais peuvent aussi servir à rendre le catalyseur moins réactif et plus sélectif. C'est par exemple le cas du catalyseur de Lindlar, un catalyseur hétérogène dont certains sites sont désactivés par l'action de l'acétate de plomb. Des poisons « classiques » sont les composés sulfurés (thiols par exemple, dont l'effet négatif sur le catalyseur augmente avec la longueur de la chaine carbonée). Basiquement, les poisons de catalyseurs peuvent être classés en trois groupes :
- les composés comportant des éléments non métalliques comme l'azote, du phosphore, de l'arsenic, de l'antimoine, du soufre, du sélénium, du tellure, du brome, l'iode et parfois du chlore.
- les composé et ions métalliques. Par exemple Cu2+, Cu+, Ag+, Au+, Zn2+, Cd2+, Hg22+, Hg2+, Mn2+, Fe2+, Co2+ et Ni2+ sont des poisons pour des catalyseurs au platine.
- les composés complexants les métaux, par exemple les ions cyanure, le monoxyde de carbone ou le benzène.
Catalyseur homogène
Parmi les catalyseurs homogènes, on peut notamment citer le catalyseur de Wilkinson, à base de rhodium, ou encore le catalyseur de Crabtree à base d'iridium.
- Exemple : hydrogénation de la carvone :
L'hydrogénation est sensible à l'encombrement stérique, ce qui explique l'absence de réaction avec la double liaison exocyclique.
L'activité et la sélectivité des catalyseurs homogènes est ajustée en faisant varier les ligands. Pour un composé prochiral, la sélectivité de la catalyse peut être ajustée de telle façon que la production d'un seul énantiomère soit favorisée. Les techniques utilisant des catalyseurs homogènes ont réellement commencé à se développer dans les années 1960, l'essentiel des catalyseurs utilisés étant alors des catalyseurs hétérogènes. Bien que les techniques se soient développées, les catalyseurs homogènes sont moins réactifs que les catalyseurs hétérogènes, et ces derniers sont donc toujours les plus employés.
Catalyseur hétérogène
Les catalyseurs hétérogènes sont les plus utilisés pour l'hydrogénation dans l'industrie. Comme pour les catalyseurs homogènes, leur activité peut être ajustée en changeant l'environnement autour du métal c'est-à-dire sa sphère de coordination. Ainsi, par exemple les différentes faces d'un catalyseur hétérogène cristallin peuvent avoir des activités distinctes.
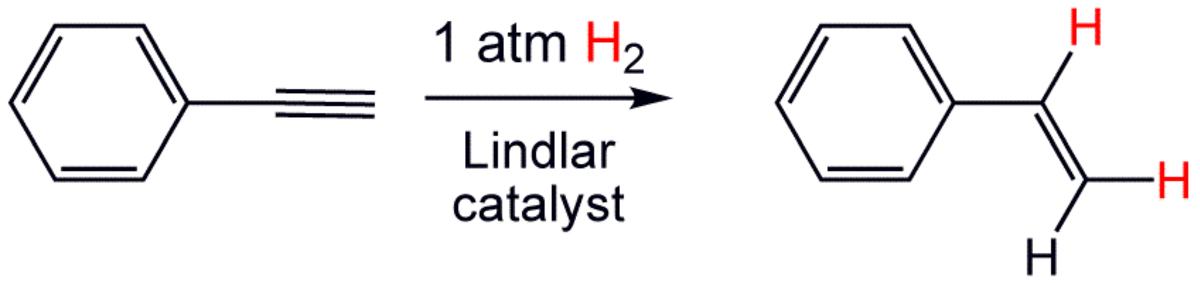
Dans certains cas, le catalyseur hétérogène est modifié par l'action d'un poison sélectif. Celui-ci transforme l'activité du catalyseur pour le rendre partiellement réactif, afin de n'hydrogéner qu'une ou plusieurs fonctions choisies, sans en affecter d'autres, comme par exemple l'hydrogénation d'un groupe alcène sans toucher au(x) cycle(s) aromatique(s) aussi présents, ou à l'hydrogénation partielle des alcynes pour former l'alcène correspondant, et pas directement l'alcane (double hydrogénation). C'est par exemple le cas du catalyseur de Lindlar, catalyseur à base de palladium sur de carbonate de calcium, empoisonné par un composé comportant du plomb (acétate de plomb, oxyde de plomb) afin de désactiver une partie des sites du palladium, et de le rendre ainsi moins réactif. Ce catalyseur permet par exemple la conversion du phénylacétylène en styrène.
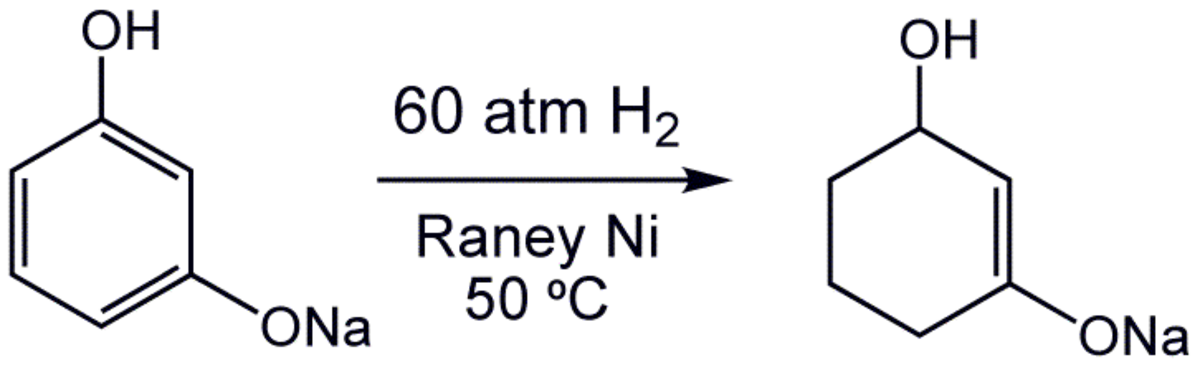
Alors que l'hydrogénation est dans la plupart des cas une addition syn, une hydrogénation asymétrique est également possible par une catalyse hétérogène, sur un métal modifié par un ligand chiral.