Hybridation (chimie) - Définition
La liste des auteurs de cet article est disponible ici.
L'hybridation
Une manière de répondre au problème de l'existence et de la géométrie de ce type de molécule est l'hybridation des orbitales atomiques. Historiquement, ce concept est apparu pour expliquer les liaisons chimiques dans des systèmes très simples (comme le méthane). Il s'est avéré ensuite que cette théorie est applicable plus largement et elle fait aujourd'hui partie des bases de la compréhension de la chimie organique. Elle est moins facilement applicable aux branches de la chimie pour lesquelles sont mis en jeu des atomes lourds. La théorie de l'hybridation pour la chimie des éléments de transition est plus compliquée et conduit à des résultats nettement moins précis.
Les orbitales (orbitales atomiques, orbitales hybrides ou orbitales moléculaires) constituent un modèle représentant la manière dont les électrons se comportent autour des noyaux atomiques. Dans le cas de l'hybridation, le modèle est basé sur les orbitales atomiques de l'hydrogène. Les orbitales hybrides sont des mélanges de ces orbitales atomiques où elles se recouvrent en différentes proportions. Les orbitales atomiques utilisées comme base sont celles de l'hydrogène car il s'agit du seul cas pour lequel il est possible de résoudre exactement l'équation de Schrödinger. Les orbitales obtenues sont alors légèrement déformées dans les atomes plus lourds comme le carbone, l'azote et l'oxygène.
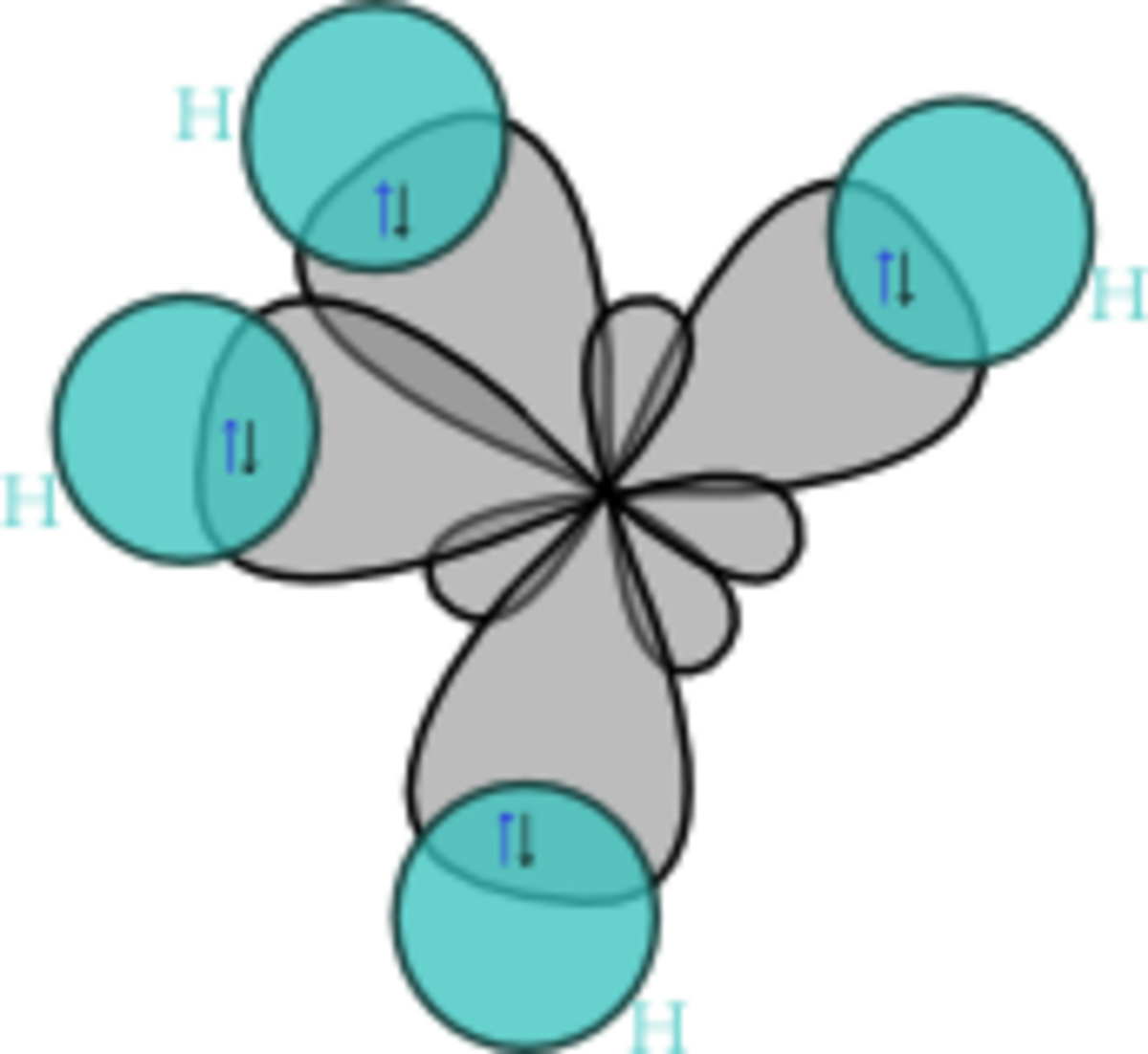
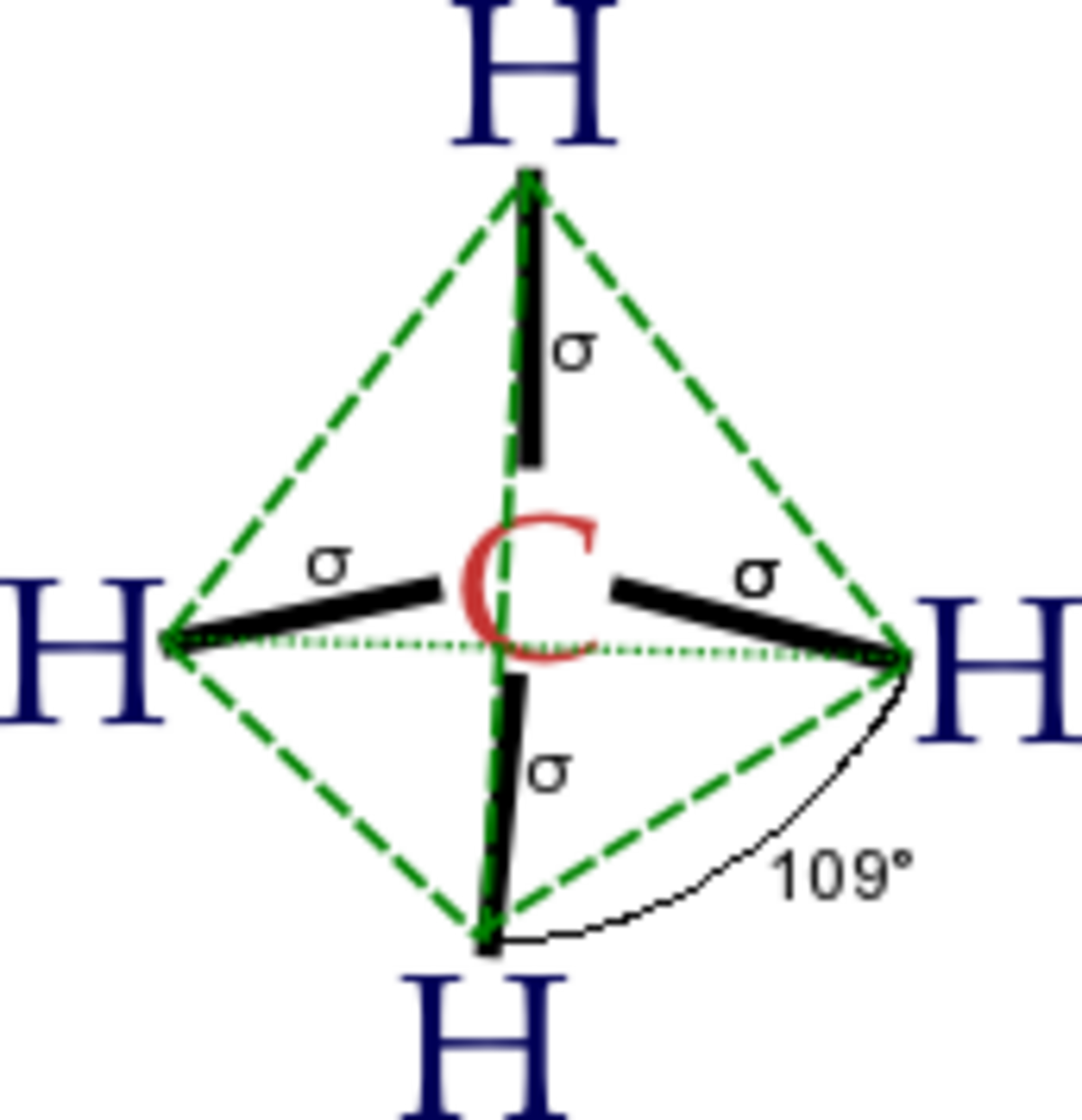
La première étape dans la construction des orbitales hybrides est l'excitation d'un (ou plusieurs) électron(s). Pour simplifier, la suite du texte traite plus particulièrement de l'exemple de la molécule de méthane. Le proton constituant le noyau d'un atome d'hydrogène attire l'un des électrons de valence du carbone. Celui-ci occupe alors un état excité, avec un électron 2s occupant une orbitale 2p. En conséquence, l'influence du noyau de l'atome de carbone sur les électrons de valence augmente du fait de l'augmentation de la charge effective (charge effectivement ressentie par les électrons : elle est égale à la charge du noyau diminuée de l'écrantage causé par les autres électrons). La combinaison de ces forces (attraction par le noyau d'hydrogène et modification de l'attraction par le noyau de carbone) conduit à de nouvelles fonctions mathématiques, les orbitales hybrides. Dans le cas de l'atome de carbone lié à quatre atomes d'hydrogène, il se crée quatre nouvelles orbitales : l'orbitale 2s se mélange avec les trois orbitales 2p pour former quatre orbitales hybrides sp3 :
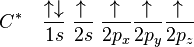
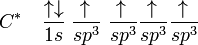
Dans CH4, ces quatre orbitales sp3 se recouvrent avec les quatre orbitales 1s des quatre atomes d'hydrogène ce qui conduit à la formation de quatre liaisons sigma. Ces quatre liaisons ont la même longueur et la même énergie, ce qui est conforme aux résultats expérimentaux.
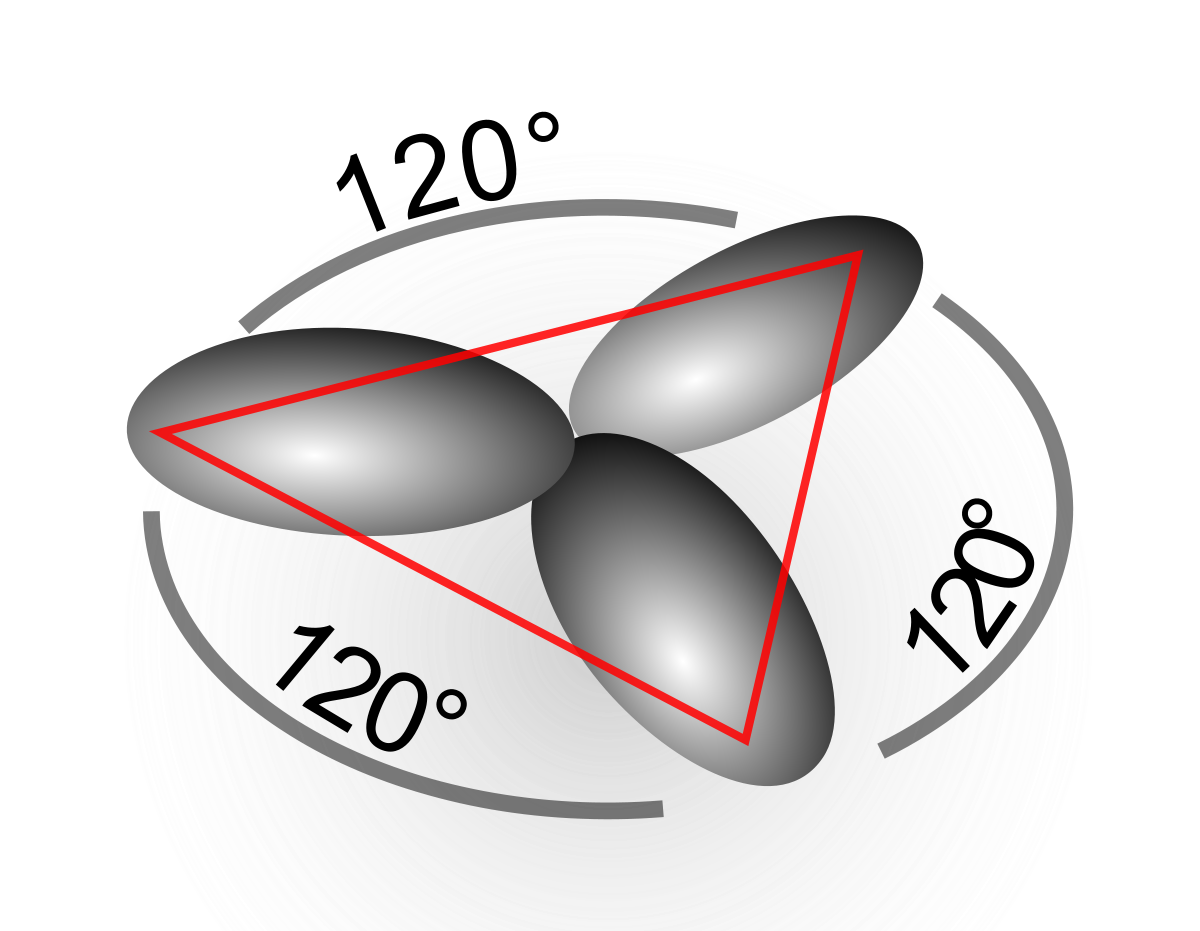
La structure des autres molécules organiques s'explique de manière similaire. Par exemple dans l'éthylène, les orbitales atomiques du carbone se mélangent pour former des orbitales hybrides sp2, et le recouvrement entre les atomes de carbone et avec ceux d'hydrogène conduit à la formation de quatre liaisons C-H de type sigma et à une double liaison C-C (liaison de type σ -recouvrement axial- superposée par une liaison de type π -recouvrement lateral-.
La proportion de caractère p n'est pas restreinte à des valeurs entières, et il existe par exemple des orbitales hybrides sp2.5. Dans ce cas, la géométrie est déformée par rapport aux orbitales hybrides "idéales". D'après la règle de Bent, le caractère p d'une liaison est d'autant plus grand qu'elle est dirigée vers un élément plus électronégatif.