Histoire de la thermodynamique classique - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
L'histoire de la thermodynamique classique tente de retracer l'origine et l'évolution des idées, des méthodes, des hommes et des connaissances de la thermodynamique, discipline étudiant le comportement thermique des corps et les changements d’état de la matière.
Dans un premier temps, la thermodynamique ne s'intéresse qu'aux phénomènes thermiques (chaleur, température) liés à des propriétés macroscopiques des systèmes étudiés, ainsi qu'à l'explication des machines à vapeur. Il s'agit de la « thermodynamique classique » dont plusieurs « principes » sont ainsi établis. Les propriétés physiques microscopiques de la matière étant par la suite mieux connues, la discipline étend son étude à des considérations statistiques permettant une meilleure explication des principes ; d'où le nom de « thermodynamique statistique ». L'article ci présent ne s'intéresse qu'à la première acception de la thermodynamique.
Antiquité

Illustration de 1876.
Amalgame sur le terme chaleur
Durant l'Antiquité, les physiciens ne font pas la distinction entre chaleur et température. Au terme « chaleur », ils associent à la fois la sensation sur le corps et le phénomène physique. Au Ve siècle av. J.-C., certains philosophes de la Grèce antique, et notamment Empédocle d'Agrigente, plaident pour une décomposition du monde en quatre éléments fondamentaux : l'eau, la terre, l'air et le feu. Selon Aristote, le chaud, le froid, le sec et l'humide forment les « quatre qualités fondamentales sous l'influence desquelles la matière première du monde forma les quatre éléments ».
L'Éolipyle
Héron d'Alexandrie, ingénieur, mécanicien et mathématicien grec, conçoit l'éolipyle (« porte d'Eole »), machine pneumatique constituée d’une sphère fixée sur un axe et équipée de deux tubes coudés sortant en des points opposés. En chauffant l'eau contenue dans la sphère métallique, la vapeur d'eau formée donne, en s’échappant, un mouvement de rotation à la sphère. En effet, de cette chaudière sortent un tube creux relié à une sphère pouvant tourner autour d'un axe horizontal et deux autres tubes perpendiculaires à l'axe laissant sortir la vapeur qui, par propulsion, faisait tourner la sphère.
Héron d'Alexandrie est dès lors un des premiers à démontrer qu'en fournissant de la chaleur à l'eau, le changement d'état de ce fluide permet de récupérer un travail.
Le XIXe siècle
Les Réflexions de Sadi Carnot
La thermodynamique classique telle quelle est formulée actuellement trouve ses racines dans les Réflexions sur la puissance motrice du feu, rédigées par le physicien français Sadi Carnot en 1824. Découvertes nouvelles qui « n'ont été suggérées par aucun de ses devanciers », Carnot met en lumières les machines thermiques, décrite par un cycle, le « cycle de Carnot ». Il analyse scientifiquement l'efficacité des moteurs à vapeur et énonce ainsi une loi fondamentale de la thermodynamique : « La production de travail par une machine à feu est intimement lié au transport d'une certaine quantité de calorique du foyer au réfrigérant ; [...] la chaleur n'engendre de puissance motrice qu'à la condition de passer d'un corps chaud à un corps froid ».
Il met par ailleurs en évidence une relation importante régissant le rendement d'une machine thermique idéale décrite par un cycle. Il explique ainsi que ce rendement, c'est-à-dire l'efficacité thermodynamique, ne dépend ni de la nature de la machine ni des fluides utilisés pour la faire fonctionner, mais uniquement des températures du corps chaud et du corps froid. Dans ses observations sur les machines à vapeur, Carnot constate que la production d'une puissance motrice s'accompagne nécessairement d'une chute de calorique entre deux corps à différentes températures. Comme la majorité de la communauté scientifique de l'époque, il considère la chaleur comme un calorique indestructible si bien qu'il ne considère pas cette diminution comme la traduction d'une « utilisation » de chaleur.
« La puissance motrice est due, dans une machine à vapeur, non à une consommation réelle de calorique, mais à son transport d'un corps chaud à un corps froid. [...] D'après ce principe, il ne suffit pas, pour donner naissance à la puissance motrice, de produire de la chaleur ; il faut encore se procurer du froid. »
— Sadi Carnot
C'est à partir de ces réflexions que le deuxième principe de la thermodynamique, historiquement découvert avant le premier, établit l'irréversibilité des phénomènes physiques, en particulier lors des échanges thermiques. L'origine de cette deuxième loi de la thermodynamique remonte à 1824, ainsi découvert par Carnot. L'énoncé est dans un premier temps « banal », avant de subir de nombreuses modifications lui accordant ainsi une plus grande importance.
Second principe de la thermodynamique
L'énoncé de Kelvin
William Thomson, mieux connu sous le nom de Lord Kelvin, physicien britannique, est célèbre pour ses travaux sur la thermodynamique. Il est d'ailleurs à l'origine d'un énoncé historique du second principe, dit de Thompson :
« Soit un cycle monotherme. Il ne peut être moteur. »
Selon cet énoncé, il est donc impossible d'obtenir un travail d'un cycle sans extraire de la chaleur d'une source et d'en transférer une partie vers une source plus froide. Transformer directement l'énergie thermique en travail est donc impossible. L'exemple d'un navire équipé du moteur à glace est généralement utilisé pour comprendre ce principe. Le navire pompe l'eau qui l'entoure, en extraie de la chaleur transformée en travail et la rejette donc sous forme de glace. Ne contredisant pas le premier principe de la thermodynamique, ce moteur ne peut exister car il n'est en contact qu'avec une seule source de chaleur.
Par la suite, Émile Clapeyron présentera en 1834, une formulation de la seconde loi de la thermodynamique, ne modifiant pas le fond du principe.
Formulation de Clausius
Rudolf Clausius, physicien allemand, énonce également en 1850 une version quelque peu différente de l'énoncé de Kelvin. La formulation de Clausius « rend compte de la direction naturelle suivant laquelle l'énergie se redistribue irréversiblement ». En effet, les corps chauds placés dans un milieu plus froid cèdent spontanément de la chaleur alors que le processus inverse nécessite que l'on fournisse de l'énergie.
« Aucun processus n'est possible, si son résultat unique est le transfert d'une quantité d'énergie thermique d'un corps à basse température vers un corps dont la température est plus élevée. »
Clausius est le premier à remettre en cause la thermodynamique conçue par Carnot. Il est admis à cette époque qu'un corps dissipe autant de chaleur qu'il n'en absorbe durant un cycle, traduisant ainsi la conservation de la chaleur. Clausius considère que le transport de chaleur d'un corps à un autre s'accompagne nécessairement d'une consommation de chaleur. Sans infirmer les travaux de Carnot, il établit des relations sur les phénomènes calorifiques que les théories futures devront nécessairement conserver. Par la suite, Ludwig Boltzmann et Max Planck étayeront également la loi.
Premier principe de la thermodynamique
Le premier principe de la thermodynamique stipule que lors de toute transformation, il y a conservation de l'énergie. Dans le cas des systèmes thermodynamiques fermés, il s'énonce de la manière suivante :
« Au cours d'une transformation quelconque d'un système fermé, la variation de son énergie est égale à la quantité d'énergie échangée avec le milieu extérieur, sous forme de chaleur et sous forme de travail. »
Cette formulation n'est pas sans s'éloigner de celle de Lavoisier : « Rien ne se perd, rien ne se créer, tout se transforme ». La première occurrence de ce principe apparait dans les travaux de Julius Robert von Mayer, bien que ces derniers suscitent peu d'intérêts à l'époque. C'est seulement en 1845 qu'il énonce officiellement cette loi.
Équivalent mécanique de la chaleur
« S'il est démontré que, dans beaucoup de cas, la dispersion de mouvement n'a pas d'autre suite appréciable qu'une production de chaleur, nous devons préférer l'hypothèse d'une relation de causalité à l'hypothèse qui ferait de la chaleur un effet sans cause et du mouvement, une cause sans effet. »
— Julius Robert von Mayer
Mayer s'intéresse dans les années 1840, à des propriétés oubliées thermodynamique, notamment sur l'expansion des gaz. Convaincu par le fait que les « forces sont causes », i.e. qu'il n'y a pas d'effet sans cause et pas de cause sans effet, il désire établir une relation numérique entre travail et chaleur, afin de donner une valeur approximative de ce qu'il nomme l'« équivalent entre travail et chaleur ». Néanmoins, les travaux de Mayer n'intéressent pas les physiciens et il faudra attendre 1843, pour que James Prescott Joule établisse cette équivalence.
En effet, Joule est connu pour être un « expérimentateur de génie », ayant conçu de nombreux appareils afin de produire de la chaleur. Le plus célèbre est celui qui permet d'établir la relation entre travail et chaleur est un dispositif muni d'une roue à palette, mis en rotation par la chute de masse. Les palettes sont placées dans un calorimètre rempli d'eau. En comparant le travail effectué par le chute des deux masses avec l'énergie thermique fournie à l'eau, Joule établit que : « 4,186 J = 1 cal ». C'est-à-dire qu'il faut apporter 4,18 J pour élever de 1 °C, un gramme d'eau. Dans un premier temps, les publications de Joule sont accueillies avec silence et ce n'est qu'en 1845 que Joule démontre officiellement l'équivalence. À une réunion de la British Association à Cambridge, Joule présente ses travaux qu'il publia peu de temps avant dans On the mechanical equivalent of heat.
Les découvertes de Kelvin
Détente de Joule Thomson
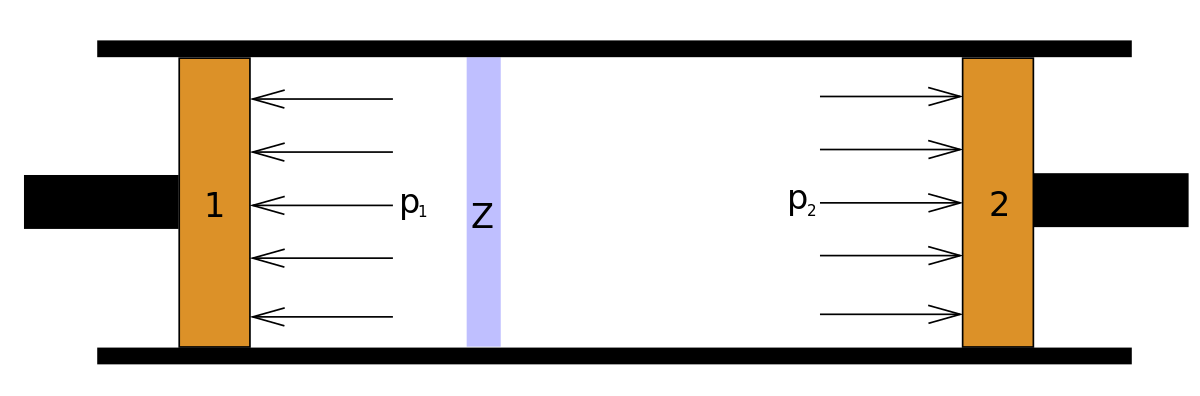
En 1852, James Joule et Lord Kelvin démontrent qu'un gaz en extension se refroidit rapidement. Communément appelée « Détente de Joule-Thomson », cette expérience met en évidence les différences de comportements entre les gaz réels et les gaz parfaits. Pour cela, les deux physiciens enferment un gaz entre deux pistons séparés par une paroi poreuse et dont les pressions de part et d'autre restent constantes. Ils démontrent que la transformation est isenthalpique.
Point absolu
L'échelle de température établie par Anders Celsius - le zéro et le 100 °C correspondent aux changements d'état de l'eau sur Terre - tout comme celle établie par Fahrenheit ne correspondent à aucun phénomène physique fondamental ayant, non seulement lieu sur Terre, mais également dans l'Univers. Les scientifiques de l'époque se sont donc posé la question s'il existait un zéro absolu de température dans l'Univers, la plus basse température possible.
L'état du zéro absolu est proposé pour la première fois par Guillaume Amontons en 1702. Amontons travaillait sur la relation entre température et pression dans les gaz même s'il n'avait pas à sa disposition de thermomètre précis. Bien que ses résultats soient quantitatifs, il établit que la pression d'une quantité donnée de gaz confinée dans un volume donné augmente d'à peu près un tiers lorsqu'il passe d'une température « froide » à celle de l'ébullition de l'eau. Son travail l'amène à supposer qu'une réduction suffisante de température entraînerait une absence de pression.
En 1848, William Thomson propose une échelle de température absolue, qui ne dépend pas du choix arbitraire d'un matériau thermométrique, dans laquelle une réduction d'un « degré d'une quantité de chaleur unité » correspond à la production d'une même quantité de forces motrices dans tous les intervalles de l'échelle. Il réalise ainsi une correction de l'échelle du thermomètre à air dont Clapeyron démontra auparavant que la diminution d'un degré produit une force motrice plus faible dans la partie des températures élevées. Ce concept, en se libérant des contraintes de la loi des gaz, établit un zéro absolu comme étant la température à laquelle plus aucune chaleur ne peut être tirée du corps.
Théorie cinétique des gaz
La théorie cinétique des gaz, par une modélisation simple des propriétés des gaz parfaits, cherche à expliquer le comportement macroscopique d'un gaz à partir des caractéristiques des mouvements des corpuscules qui le composent. Elle est notamment étudiée par Johann Joachim Becher, qui introduit cette théorie dans ses publications Hydrodynamique, en 1738, avant d'être reprise par de nombreux physiciens. James Clerk Maxwell et Ludwig Boltzmann en ont formalisé son expression mathématique.
Découverte de Brown

En 1827, le botaniste Robert Brown théorise le mouvement d'une particule dans un fluide, qu'il nomme « mouvement brownien ». Il s'agit d'une description mathématique d'un mouvement aléatoire de cette particule, soumise à aucune interaction extérieure. C'est en observant le mouvement continu et erratique d'une particule de pollen de Clarkia pulchella qu'il découvre ce phénomène. Pensant dans un premier temps qu'il s'agissait de « la molécule primitive » responsable de la vie, il constate par la suite que des particules suffisamment petites d'autres plantes sont soumises au même phénomène.
Ce mouvement permet de décrire avec succès le comportement thermodynamique des gaz. En effet, suite à de nombreux travaux, différents physiciens suggèrent que ce phénomène est dû aux chocs des molécules d'eau sur les particules de pollen. Les travaux de Louis Georges Gouy permettent de montrer que l'amplitude du mouvement est d'autant plus grande que la particule est petite. Par ailleurs, la théorie du mouvement brownien permet d'expliquer le phénomène de diffusion. Si un certain nombre de particules est placé dans un fluide, leur concentration tend à s'uniformiser.
Équation de Boltzmann
Ludwig Boltzmann formalise mathématiquement en 1872 l'évolution d'un gaz peu dense hors équilibre. L'« équation de Boltzmann » est équation intégro-différentielle de la théorie cinétique permettant d'évaluer la répartition des énergies cinétique, à une température donnée, des molécules d'un gaz.
Boltzmann considère que le système étudié est composé d'un grand nombre de « petit » systèmes isolés de même nature se distinguant les uns des autres par leur phase — à savoir leur configuration et leur vitesse. Ne pouvant suivre l'évolution de l'un de ces systèmes, il « détermine la distribution de l'ensemble des systèmes parmi toutes les phases qu'ils peuvent prendre à un instant quelconque ». Ces considérations statistiques sont les prémices à l'établissement de la physique statistique.
Travaux de Van der Waals
Van der Waals, physicien néerlandais, est notamment célèbre pour ses travaux sur les gaz. Il soutient à l'université de Leyde sa thèse de doctorat Sur la continuité des états gazeux et liquide. Le 4 juin 1873, il établit une équation d'état approché des gaz réels. Pour cela, il modifie l'équation d'état des gaz parfaits (PV=nRT) en apportant des termes correctifs à la pression et au volume. Néanmoins, cette approximation n'est valable que pour des faibles pressions. La relation de Van der Waals est remarquable dans le sens où il abandonne le modèle statique pour celui de la répartition uniforme datant de Laplace et Newton.
Entropie
Première définition
Le concept d'entropie est formulé en 1865 par Clausius dans le but de pouvoir distinguer la conservation et l'irréversibilité. En effet, lors de la détente spontanée d'un gaz, ce dernier ne peut plus fournir de travail alors que son énergie est inchangée. Bien que l'opérateur, pour comprimer le gaz à nouveau, doive fournir un travail équivalent à celui « perdu », l'état final du système sera différent de l'état initial. L'entropie est donc une grandeur du système, une fonction d'état, « gouvernant le sens de l'évolution naturelle de tous les systèmes ».
Ordre et désordre
Suite à l'extension de la discipline à la physique statistique, la notion d'entropie est reformulée en termes d'ordre (travail) et de désordre (chaleur), par Boltzmann en 1878. Désormais, l'entropie mesure le degré de désordre d'un système au niveau microscopique. Plus l'entropie du système est élevée, moins ses éléments sont ordonnés, liés entre eux, capables de produire des effets mécaniques, et plus grande est la part de l'énergie inutilisée pour l'obtention d'un travail. Le fait qu'il est difficile de transformer de la chaleur en travail résulte justement du désordre de la chaleur, en raison de l'« agitation thermique en tout sens des molécules ». Le sens de l'évolution de toute transformation est celui du plus grand désordre, c'est-à-dire de la plus grande entropie.