Hémoglobine - Définition
La liste des auteurs de cet article est disponible ici.
Structure
On trouve au cœur de la molécule un cycle hétérogène porphyrique, l'hème, qui contient un ion fer. Cet ion fer est le site de fixation de l'oxygène. Étant donné qu'une sous-unité de l'hémoglobine est formée par un hème enfermé dans une protéine globulaire le nom est très logique. Il y a de nombreuses protéines contenant un hème, mais l'hémoglobine en est la plus connue. L'élément fer peut exister sous 2 formes dans la molécule :
- sous forme ferreuse, ion Fe2+ : seule forme active de l'hémoglobine humaine. On parle d'oxyhémoglobine. (pas d'interactions possibles).
- sous forme ferrique, ion Fe3+ : on parle de méthémoglobine. (interactions possibles)
On peut parler du pouvoir oxyphorique de l'hémoglobine. Ceci correspond à la quantité de dioxygène qu'elle peut fixer. Cette valeur est de 1,34 ml d'O2/g d'Hb.
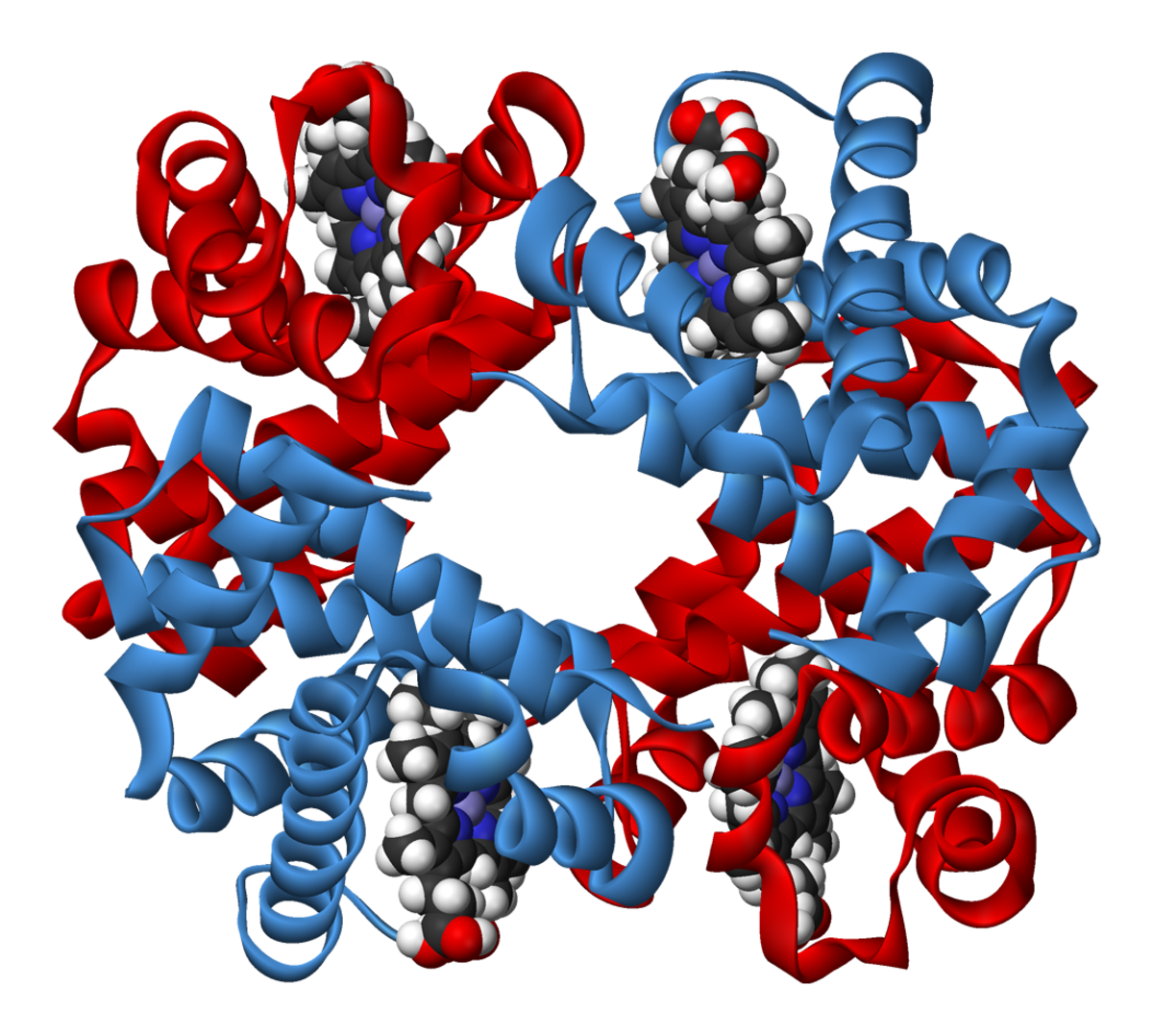
Hémoglobine humaine
Chez l'homme, l'hémoglobine est un tétramère, constitué de deux globines α et deux globines β liées par des liaisons faibles. Les sous-unités sont structurellement similaires et ont à peu près la même taille. Chaque globine a une masse moléculaire d'environ 17 000 daltons, pour une masse totale d'environ 68 000 daltons. Chaque globine de l'hémoglobine contient un hème, de telle manière que la capacité totale de liaison de l'hémoglobine pour le dioxygène est de quatre molécules.
Étapes de réaction :
- Hb + O2 ↔ HbO2
- HbO2 + O2 ↔ Hb(O2)2
- Hb(O2)2 + O2 ↔ Hb(O2)3
- Hb(O2)3 + O2 ↔ Hb(O2)4
Résumé de la réaction :
- Hb + 4O2 → Hb(O2)4
Une structure de la forme désoxy de l'hémoglobine humaine est donnée par le PDB 1A3N.
En pratique, on n'observe pas ceci :
- Hb + 4O2 ↔ Hb(O2)4
En effet, dans les conditions physiologiques, deux sous-unités sont toujours oxygénées par molécule d'hémoglobine. On peut donc écrire :
- Hb(O2)2 + 2O2 ↔ Hb(O2)4
Valeurs normales chez l'adulte
- Hommes : 13 - 17,87 g/dL de sang ou 8,3 - 10,5 mmol/L de sang.
- Femmes : 12,10 - 16,40 g/dL de sang ou 7,4 - 9,9 mmol/L de sang.
Attention, pour la femme enceinte et l'enfant, ce taux diminue considérablement.
Hémoglobine du grand dauphin
La composition de l'hémoglobine du grand dauphin océanique lui permet de rester immergé durant une plus grande période de temps que le grand dauphin vivant plus près des côtes.
Utilisation clinique
En médecine, plusieurs termes se rapportent à l'hémoglobine :
- Le taux d'hémoglobine est exprimé en g/100 mL. Les valeurs normales du taux d'hémoglobine dépendent du sexe et de l'âge du sujet. Un taux d'hémoglobine inférieur à la norme définit une anémie.
- La saturation SaO2 définie en % est calculée par la quantité d'oxyhémoglobine divisé par la quantité totale d'hémoglobine du sang. La saturation SaO2 peut être mesurée sur du sang veineux ou du sang artériel. La saturation en oxygène du sang est un des paramètres d'un examen appelé gaz du sang. La valeur de la saturation est considérée comme dangereuse si elle est inférieure à 90 % pour du sang artériel. La valeur normale est de 100 % pour des conditions atmosphériques normales. À cette valeur, on parle de capacité en O2 du sang.
- La cyanose est un signe clinique. Il s'agit de la coloration bleutée des téguments. Elle apparaît lorsque la concentration en hémoglobine réduite dépasse les 5 g/100 mL de sang capillaire. Elle peut être masquée par une anémie.