Halogène - Définition
La liste des auteurs de cet article est disponible ici.
Réactivité des halogènes
Dans cette famille, les éléments réagissent avec des métaux pour former des composés ioniques tels que NaCl et LiF. Les halogènes réagissent aussi avec des non-métaux pour former des composés covalents. Des exemples de composés covalents sont les oxacides (ex. : HClO3), les oxydes halogénés (ex. : Cl2O) et les halogénures non-métalliques (ex. : ClF). D’ailleurs, la raison pour laquelle les halogènes sont très réactifs est expliquée par le fait que les éléments du groupe 7A doivent juste gagner un électron pour remplir leur orbitale de valence p et ainsi compléter l’octet. Ceci peut être fait de deux façons :
- gagner un électron provenant d’un métal, pour former un ion négatif tandis que le métal formera un ion positif ;
- partager un électron avec un non-métal pour former une liaison covalente.
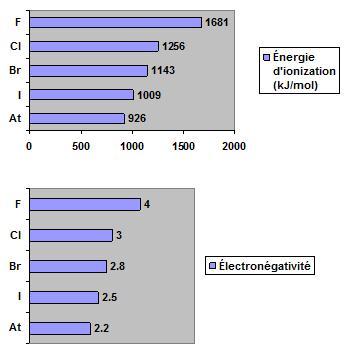
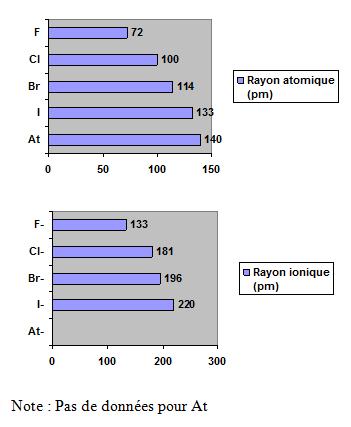
En se déplaçant de haut en bas dans le groupe 7A, il y a une augmentation du rayon atomique et une diminution de l’électronégativité.
Les halogènes possèdent la plus grande variation d’électronégativité de tous les groupes du tableau périodique (selon l’échelle de Pauling, XF = 4,0, XAs = 2,2). Dans la plupart des réactions, ces éléments agissent comme agents d’oxydation. Aussi, les halogènes qui sont plus haut dans le groupe peuvent oxyder les anions halogénures qui sont plus bas :
F2 (g) + 2X- (aq) → 2F- (aq) + X2 (aq) où X= Cl, Br, I.
Donc, la capacité d’oxydation de X2 diminue lorsqu’elle descend du groupe 7A tandis que la capacité de réduction de X– augmente lorsqu’elle descend du groupe. Plus l’ion est gros, plus il est facile de perdre un électron.
Propriétés physiques
Comme pour la plupart des groupes du tableau périodique, les propriétés physiques des groupe 17 (groupe des halogènes) varient progressivement du haut vers le bas du groupe : pour les halogènes, leur température de fusion et leur température d'ébullition croît en même temps que la polarisabilité de leur cortège électronique : plus cette polarisabilité est grande, plus grande est l'énergie requise pour rompre les liaisons intermoléculaires permettant les changements d'états du plus condensé au moins condensé.
La chimie des composés inter-halogènes
Ces halogènes réagissent de façon exothermique pour former des composés inter-halogènes. Les molécules les plus simples dans ce domaine sont les molécules diatomiques, comme le ClF ou le BrCl. La formule générale des composés inter-halogènes est XYn (n= 3,5,7). Dans chaque cas, l’atome central est le moins électronégatif et possède un état positif d’oxydation. Voici quelques exemples :
- Sn (s) + ClF3 (l) → SnF2 (s) + ClF (g) ;
- P4 (s) + 5 ClF3 (l) → 4 PF3 (g) + 3 ClF (g) + Cl2 (g) ;
- 2B2O3 (s) + 4 BrF3 (l) → 4 BF3 (g) + 2 Br2 (l) + 3 O2 (g).
Les propriétés périodiques et les halogènes
Dans ce groupe, la configuration électronique est ns2 np5. Ces éléments possèdent une orbitale p à moitié pleine capable de recevoir un électron provenant d’un autre élément, tel un alcalin. Pour le groupe des halogènes :
- le rayon atomique et le rayon ionique augmentent de haut en bas ;
- l’énergie d'ionisation et l’électronégativité diminuent de haut en bas.
| 
|

















































