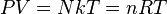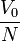Gaz parfait - Définition
La liste des auteurs de cet article est disponible ici.
Équation d'état : la loi des gaz parfaits
Expression
Comme pour tout gaz, l'état d'équilibre thermodynamique d'un gaz parfait est fixé pour n moles de molécules, par deux paramètres macroscopiques, au choix. Les autres paramètres peuvent se calculer à partir des deux paramètres choisis par l'équation d'état.
L'équation la plus couramment utilisée est l'équation des gaz parfaits.
- pV = nRT
On peut l'écrire différemment, dans une approche plus microscopique où l'on considère le nombre de molécules contenu dans une unité de volume.
- pV = NkBT
Dans ces expressions,
- p est la pression du gaz (en pascal) ;
- V est le volume occupé par le gaz (en mètre cube) ;
- n est la quantité de matière (en mole) ;
- N est le nombre de particules ;
- R est la constante universelle des gaz parfaits :
R = 8,314 472 J·K-1·mol-1
on a en fait R = NA·kB où NA est le nombre d'Avogadro (6,022×1023 mol-1) et kB est la constante de Boltzmann (1,38×10-23 J/K) ; - T est la température absolue (en kelvin).
Cette équation dérive d'autres lois trouvées auparavant : la loi de Charles, la loi de Boyle-Mariotte et la loi de Gay-Lussac.
Application numérique :
- pour une pression d'une atmosphère (p = p0 = 1,013 25×105 Pa)
- et une température de 0 °C (T = T0 = 273,15 K, température de la glace fondante sous p0),
le volume molaire est
- V0 = 22,413 996(39) L/mol
On retient en général la valeur approchée 22,4 L/mol.
Ce qui donne un volume par molécule (volume « libre » autour de la molécule, indépendamment de sa dimension) :
si l'on assimile ce volume libre à un cube, alors l'arête de ce cube est globalement la distance moyenne séparant les molécules à chaque instant, que l'on appelle « longueur de Loschmidt » d0. Cette valeur est la racine cubique du volume « libre » :
- d0 = 3,338 792 5 nm
on utilise en général la valeur approchée 3,33 nm.
Pour une pression valant un millionième de la pression atmosphérique (p0/1 000 000), la distance interparticulaire est 333 nm = 1/3 micromètre et est indépendante de la nature du gaz.
Démonstration (mécanique statistique)
On considère un gaz parfait constitué de N particules identiques, d'énergie totale E0. Le nombre de micro-états correspondants à une énergie comprise entre E0 et E0 + dE est
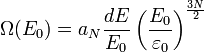
Avec
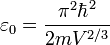
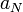
On cherche à calculer le nombre Ω de micro-états correspondants à une énergie comprise entre E0 et E0 + dE, pour cela on commence par déterminer le nombre Φ de micro-états correspondants à une énergie inférieure à E0.
Ce nombre Φ est égal au volume de l'espace des phases correspondant, divisé par une cellule élémentaire permettant de dénombrer ces micro-états classiques (en accord avec la mécanique quantique, on prend cette cellule égale à δqδp = h la constante de Planck.), et divisé par le nombre de permutations de ces N particules, N!, ce qui permet de rendre compte de leur indiscernabilité (ce qui encore dû à la mécanique quantique) :
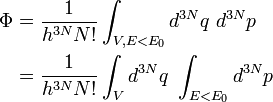
On a d'abord
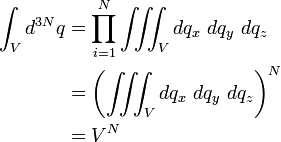
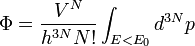
Par hypothèse, il n'y a pas d'interactions entre les particules du gaz, donc l'énergie E0 est égale à l'énergie cinétique totale
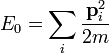
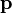
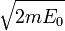
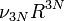
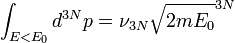
D'où :
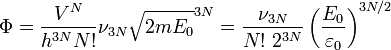
Avec
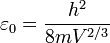
La densité de micro-états à l'énergie E0 est donc
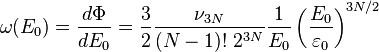
On a donc le nombre de micro-états cherché :
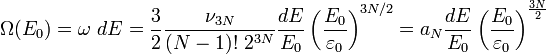
On en déduit l'entropie du gaz en fonction de l'énergie :
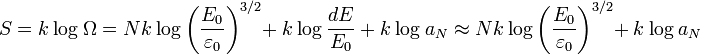
Les grandeurs thermodynamiques se calculent ensuite selon :
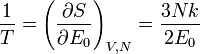
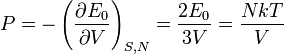
D'où la loi cherchée :