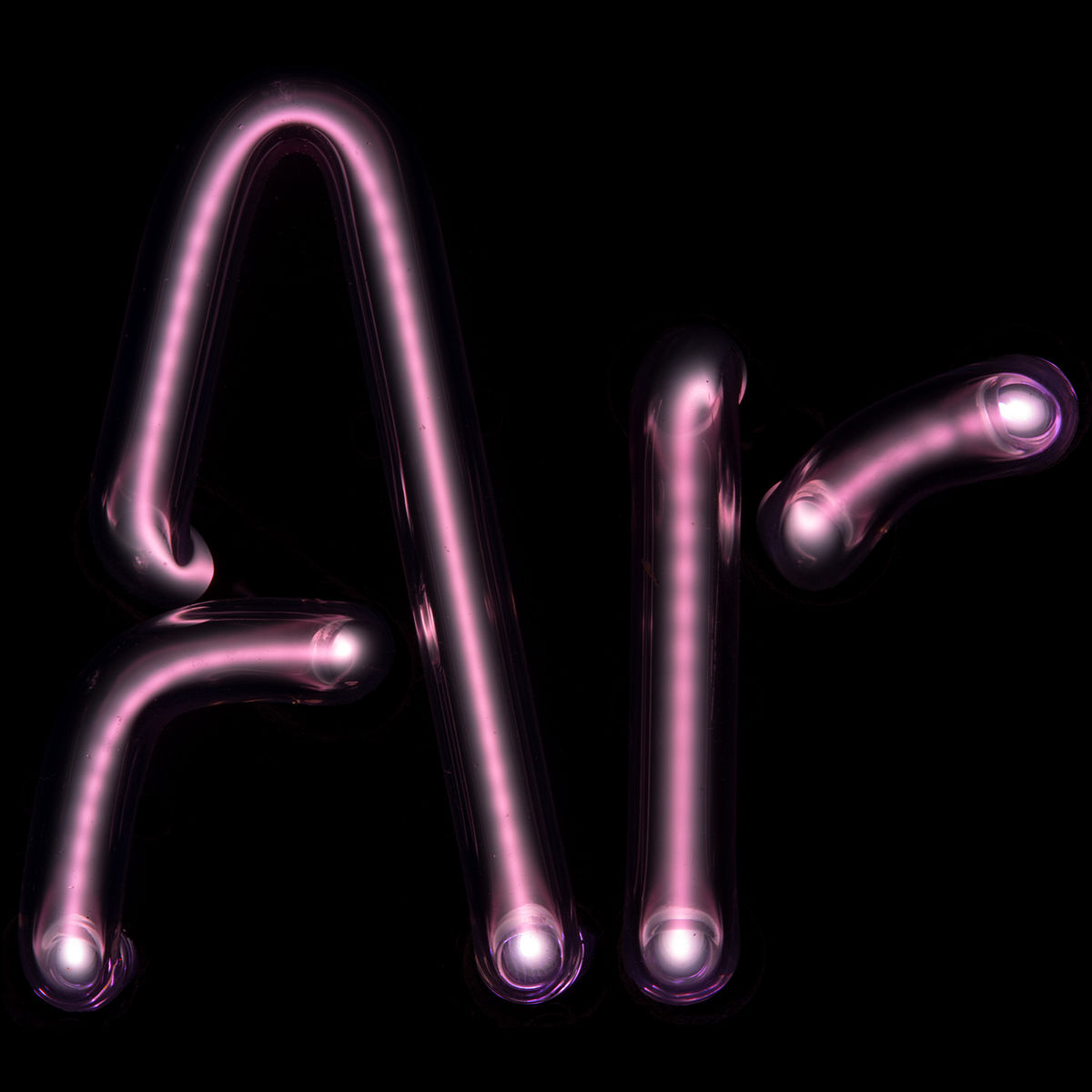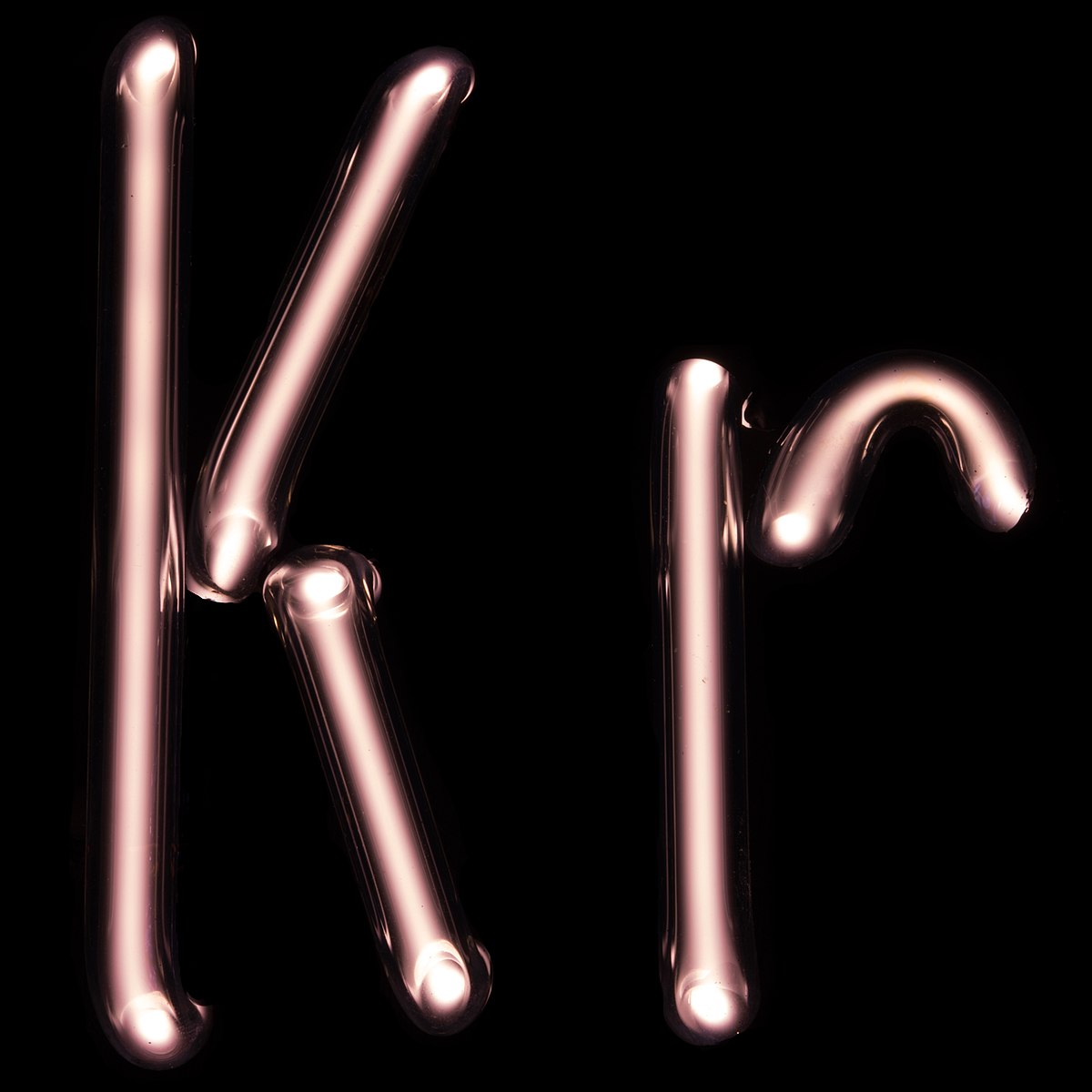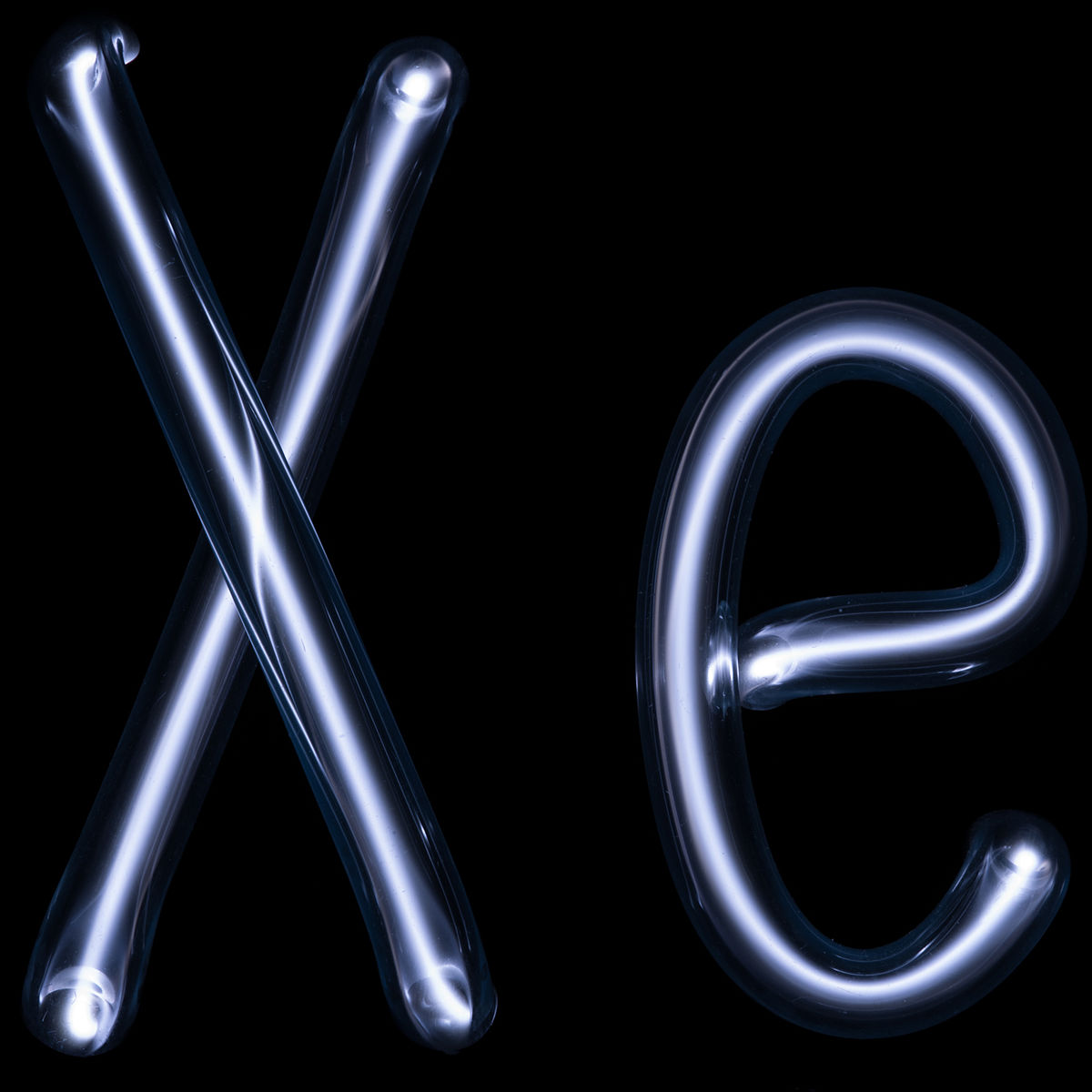Gaz noble - Définition
La liste des auteurs de cet article est disponible ici.
On appelle gaz nobles, ou plus couramment gaz rares, les éléments chimiques du groupe 18 (anciennement « groupe VIIIA » voire « groupe 0 ») du tableau périodique des éléments. L’appellation gaz rares vient de leur faible prévalence historique comme substance chimique, bien que cela soit plutôt impropre car l'hélium constitue 24 % de la matière baryonique de l'univers, et l'argon 0,94 % de l'atmosphère terrestre au niveau de la mer. Autrefois également appelés gaz inertes, cette appellation est tombée en désuétude depuis qu'on a synthétisé des centaines de composés du xénon. Préconisée par l'IUPAC et le Bulletin officiel, l'appellation gaz nobles, issue de l'allemand Edelgas par analogie avec les métaux nobles (tels que l'or, également peu réactif), apparaît donc de plus en plus comme devant légitimement remplacer à terme celle de gaz rares ; c'est celle retenue dans cet article.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | He | |||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| 6 | Cs | Ba | * | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | * | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| ↓ | |||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | |||||
| * | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | |||||
Les gaz nobles forment une série chimique ayant des propriétés assez homogènes : aux conditions normales de température et de pression, ce sont des gaz monoatomiques incolores et inodores quasiment dépourvus de réactivité chimique, dont les points de fusion et d'ébullition sont séparés de moins de 10 °C à pression atmosphérique.
Les six gaz nobles naturels sont l'hélium (He), le néon (Ne), l'argon (Ar), le krypton (Kr), le xénon (Xe) et le radon (Rn), ce dernier étant radioactif (avec une période radioactive de 3,8 jours) et produit lui-même par la désintégration radioactive du radium. Un septième élément est venu s'ajouter à la liste au début des années 2000 : l'élément 118 (ununoctium, Uuo), élément synthétique relevant de la dénomination systématique de l'UICPA ; néanmoins, si on pouvait en disposer en quantité macroscopique, cet élément ne serait sans doute pas un gaz mais plutôt un solide semiconducteur aux propriétés chimiques rappelant peut-être les métalloïdes — sa caractérisation n'ayant pas encore été validée par l'UICPA, il ne devrait, en toute rigueur, être rangé dans aucune série chimique.
La difficulté à mettre en évidence une chimie des gaz nobles provient de leur configuration électronique : les sous-couches s et p de leur couche électronique externe sont en effet complètes, avec respectivement deux et six électrons, de sorte qu'il ne leur reste pas d'électron de valence disponible pour établir une liaison chimique avec un autre atome, en vertu de la règle de l'octet.
C'est ce qui explique leur inertie chimique, inertie totale pour le néon, quasi totale pour l'hélium et l'argon (encore faut-il réaliser des conditions extrêmement particulières pour détecter indirectement de rares composés de ces atomes) mais plus relative pour le krypton et surtout le xénon, dont on a isolé plusieurs centaines de composés. Le radon semble également assez réactif, mais sa radioactivité en a freiné l'étude, tandis que l'ununoctium aurait, selon les simulations numériques, une configuration électronique affectée par des couplages spin-orbite lui conférant une réactivité chimique quasi « normale ».
-
Période Élément chimique Configuration électronique Période 1 no 2 He Hélium 1s2 Période 2 no 10 Ne Néon 1s2 2s2 2p6 Période 3 no 18 Ar Argon 1s2 2s2 2p6 3s2 3p6 Période 4 no 36 Kr Krypton 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 Période 5 no 54 Xe Xénon 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 Période 6 no 86 Rn Radon 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
Le néon, l'argon, le krypton et le xénon sont obtenus à partir de l'air par liquéfaction et distillation fractionnée. L'hélium est séparé du gaz naturel, et le radon est généralement isolé à partir des produits de désintégration de composés de radium dissous.
Les gaz nobles ont plusieurs applications technologiques importantes, telles que l'éclairage, le soudage et l'exploration spatiale. Les plongeurs utilisent un mélange d'oxygène et d'hélium afin de prévenir l'hyperoxie et la narcose à l'azote au-delà de 55 m de profondeur, et l'hélium est utilisé dans les ballons à gaz.