Fusion (physique) - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
En physique et en métallurgie, la fusion est le passage d'un corps de l'état solide vers l'état liquide.
Pour un corps pur, c’est-à-dire pour une substance constituée d'atomes ou molécules tous identiques, la fusion s'effectue à température constante. La température de fusion ou de solidification d'un corps pur, appelé « point de fusion », est une constante qui dépend très peu de la pression (contrairement à la température d'ébullition, voir diagramme de phase).
| Corps pur | Température de fusion / solidification (°C) | Température d'ébullition / liquéfaction (°C) |
|---|---|---|
| Eau | 0 °C | 100 °C |
| cyclohexane | 6 °C | 81 °C |
| Mercure | -39 °C | 357 °C |
| Fer | 1 535 °C | 2 750 °C |
Par contre, la température de fusion d'un mélange de corps purs (voir Diagramme de phase > Diagramme binaire et ternaire ) s'effectue sur une plage de température (sauf pour un eutectique), et dépend de la proportion de chaque constituant du mélange.
Dans la pratique, le corps est placé dans un récipient, afin de le contenir une fois qu'il sera liquide. On chauffe en général le récipient par dessous, à l'aide d'une flamme ou d'une résistance électrique ; la fusion commence donc par la partie en contact avec le récipient. Dans un four, la chaleur est apportée par l'air et par radiation des parois, c'est donc en priorité le dessus qui fond. En métallurgie, on pratique parfois la fusion par un arc électrique (soudure à l'arc, acier électrique) : l'énergie de chauffage est apportée par le passage du courant dans l'air entre les électrodes. Lorsque le récipient est dans un métal ferromagnétique et que le point de fusion du solide est inférieur au point de Curie du récipient, on peut chauffer par induction. Les corps non-conducteurs peuvent être chauffés par micro-ondes.
Fusion d'un corps pur
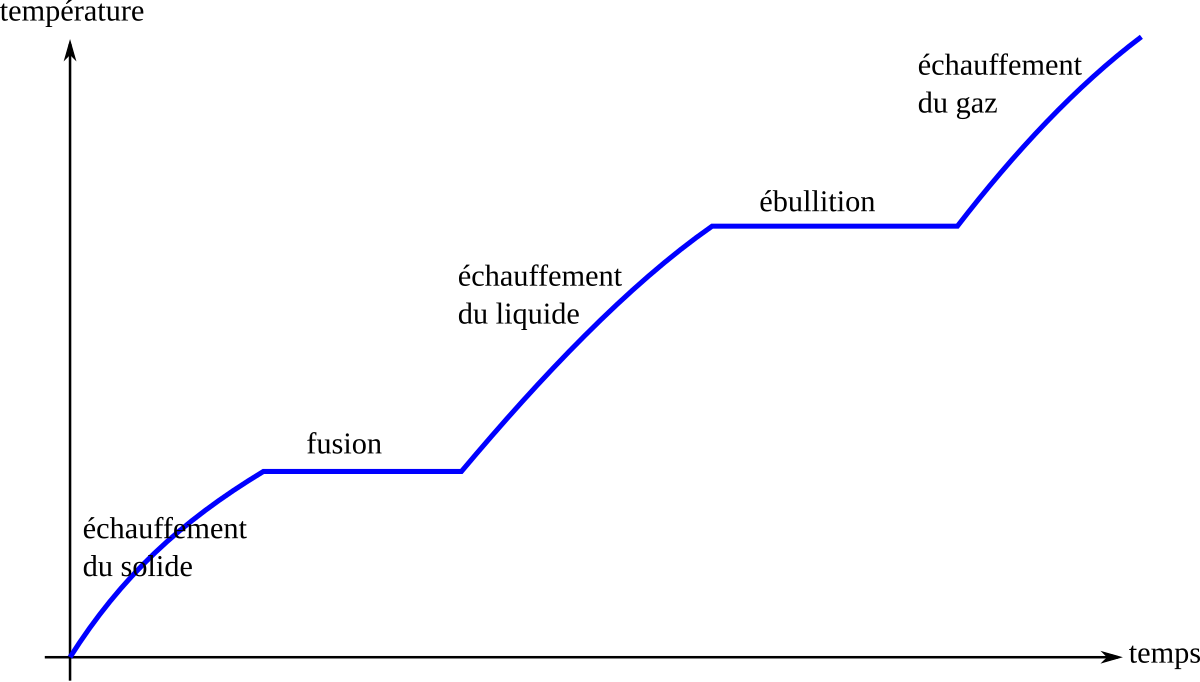
Lorsque l'on chauffe un corps pur solide, sa température augmente. Puis, arrivé au point de fusion, la chaleur apportée sert à la transformation solide → liquide, la température reste stable. Une fois la fusion terminée, la chaleur apportée fait monter la température du liquide.
La chaleur nécessaire pour faire fondre le corps est appelé enthalpie de fusion ou chaleur latente de fusion, Lf. Elle est exprimée par unité de quantité de matière (J/mol) ou par unité de masse (J/kg).
Solidification d'un système binaire
Système à solubilité totale
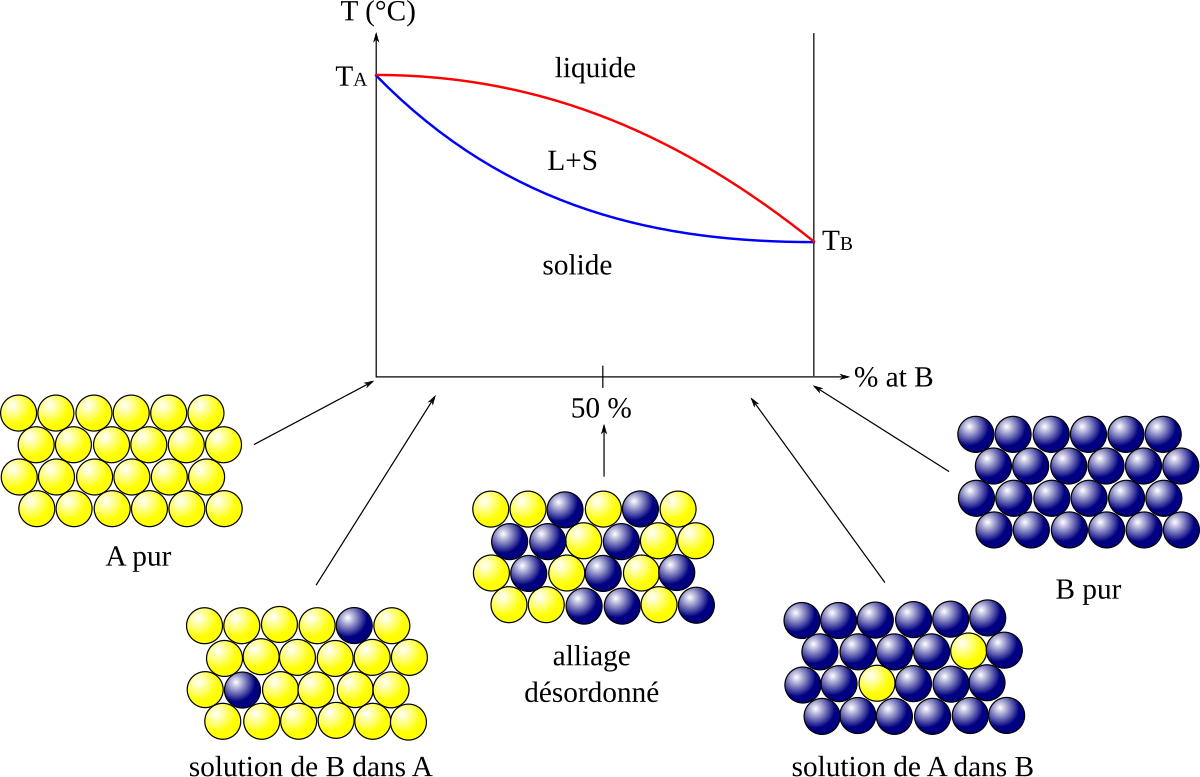
Dans certains cas, deux corps pur peuvent se mélanger parfaitement à l'état solide. C'est le cas par exemple des alliages or-argent (Au-Ag) ou bismuth-antimoine (Bi-Sb). Les atomes ou molécules des deux corps purs sont mélangées de manière aléatoire, on parle de « solution solide unique ». Dans ces cas-là, la température évolue de manière continue durant la fusion. Cependant, la courbe de chauffe s'incurve, puisque seule une partie de l'énergie apportée fait augmenter la température, l'autre partie sert à la fusion. Si l'on reporte la température de début et de fin de solidification en fonction de la composition chimique (diagramme dit « binaire »), on obtient un fuseau unique.
En fait, le système ne s'est pas solidifié de manière uniforme, la composition n'est pas la même partout dans le solide (phénomène de ségrégation). La température de fusion n'est donc pas uniforme. La solidification classique commence par les bords et se termine au centre ; la fusion suit donc l'ordre inverse, puisque le centre est la partie ayant le plus bas point de fusion.