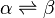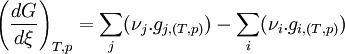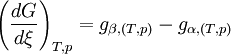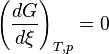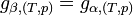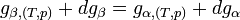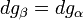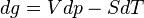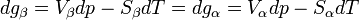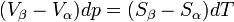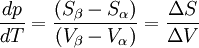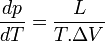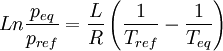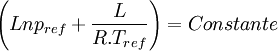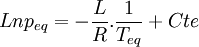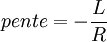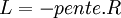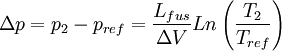Formule de Clapeyron - Définition
La liste des auteurs de cet article est disponible ici.
Établissement de la formule de Clapeyron
Un changement d'état physique est une transformation de la matière. Il est caractérisé par la coexistence de deux phases pures et s'effectue généralement à température et pression constantes. La seule variable indépendante du système est alors la variable de composition ξ, permettant de définir les quantités de chaque phase à l'équilibre. On peut alors considérer le changement d'état comme une sorte de réaction chimique particulière effectuée à T et p constante mais sans qu'il y ait changement de la nature chimique des constituants; la seule variable étant également la variable ξ. Les formules établies lors de l'étude de l'équilibre chimique peuvent être parfaitement adaptées au cas du changement d'état.
Considérons le changement d'état défini par l'équation suivante, mettant en jeu les phases α et β à T et p constantes:
Appliquons la relation concernant l'enthalpie libre, obtenue dans le cas d'un équilibre chimique:
Dans le cas d'un changement d'état cela devient:
Or, à l'équilibre
Donc, à l'équilibre les potentiels chimiques des deux phases sont égaux
Si l'on modifie la pression d'équilibre, la température d'équilibre sera modifiée (par exemple l'eau bout à 100 °C sous la pression de 1 atm mais si la pression diminue, la température d'ébullition diminue aussi). Les enthalpies libres des deux phases α et β varient elles aussi, mais elles sont toujours égales lorsque le système atteint son nouvel équilibre. On peut écrire:
et
L'enthalpie libre d'un corps pur dépend de T et de p. La différentielle est égale à:
d'où
Il s'ensuit
d'où
Le changement d'état a lieu à pression constante donc la chaleur latente mise en jeu, L, est égale à la variation d'enthalpie ΔH = Qp. Si la transformation présente un caractère de réversibilité, ΔS = Qp / T = L / T.
Applications
Détermination d'une chaleur latente
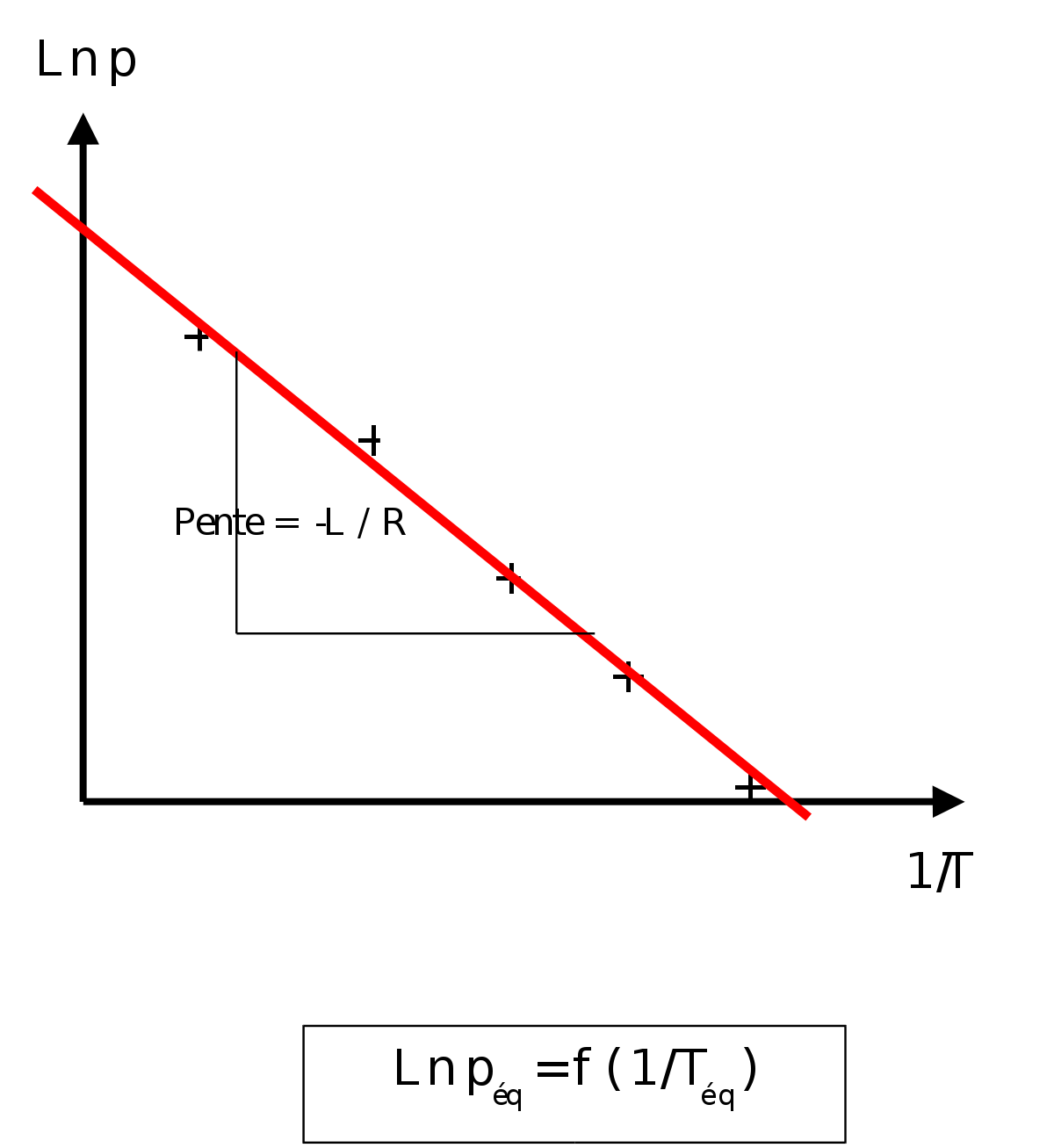
On peut mesurer expérimentalement dans un autoclave, la température et la pression d'équilibre associée, d'un gaz au contact de son liquide. On peut alors déterminer l'évolution de la pression d'équilibre ou pression de vapeur saturante en fonction de la température. Cette étude permet la détermination de la chaleur latente de changement d'état.
- Relation de Clapeyron intégrée en présence d'un gaz. On va raisonner ici sur un équilibre de vaporisation en admettant que la chaleur latente de vaporisation reste pratiquement constante sur l'intervalle de T considéré.
d'où
Si l'on trace le graphe :
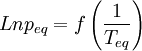
La détermination graphique de cette pente permet le calcul de la chaleur latente:
Problème pratique
- La relation intégrée dans le cas de la fusion de la glace est appliquée pour savoir s'il y aura changement de phase ou non selon les conditions de pression et de température. Par exemple, elle est souvent utilisée pour expliquer ce qui permet le patinage sur glace: l'augmentation de pression du patineur fait fondre une mince couche de glace sous le patin ce qui permet la glisse.
- Si T2 = 271K (-2 °C), utilisons la relation de Clausius-Clapeyron, pour calculer le changement de pression nécessaire:
- En utilisant les valeurs:
- L = 3,34*105 J/kg, Tref = 273K, ΔV = -9,05 *10-5 m3/kg
- nous obtenons
- Δp = 27,2 MPa.
Météorologie
-
- En météorologie, la relation de Clausius-Clapeyron est utilisée couramment dans les diagrammes thermodynamiques comme les téphigrammes, Skew-T et émagrammes pour le calcul des énergies de changement de phases de l'eau atmosphérique. Sur un tel diagramme de pression versus température (P-T), la ligne séparant les deux phases est connue comme la courbe de coexistence: dP/dT.
- Ce qui est surtout important en météorologie est la pression de saturation de la vapeur d'eau '''es''' et la relation devient alors:
-
-
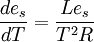
-