Formamide - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Formamide | ||
|---|---|---|
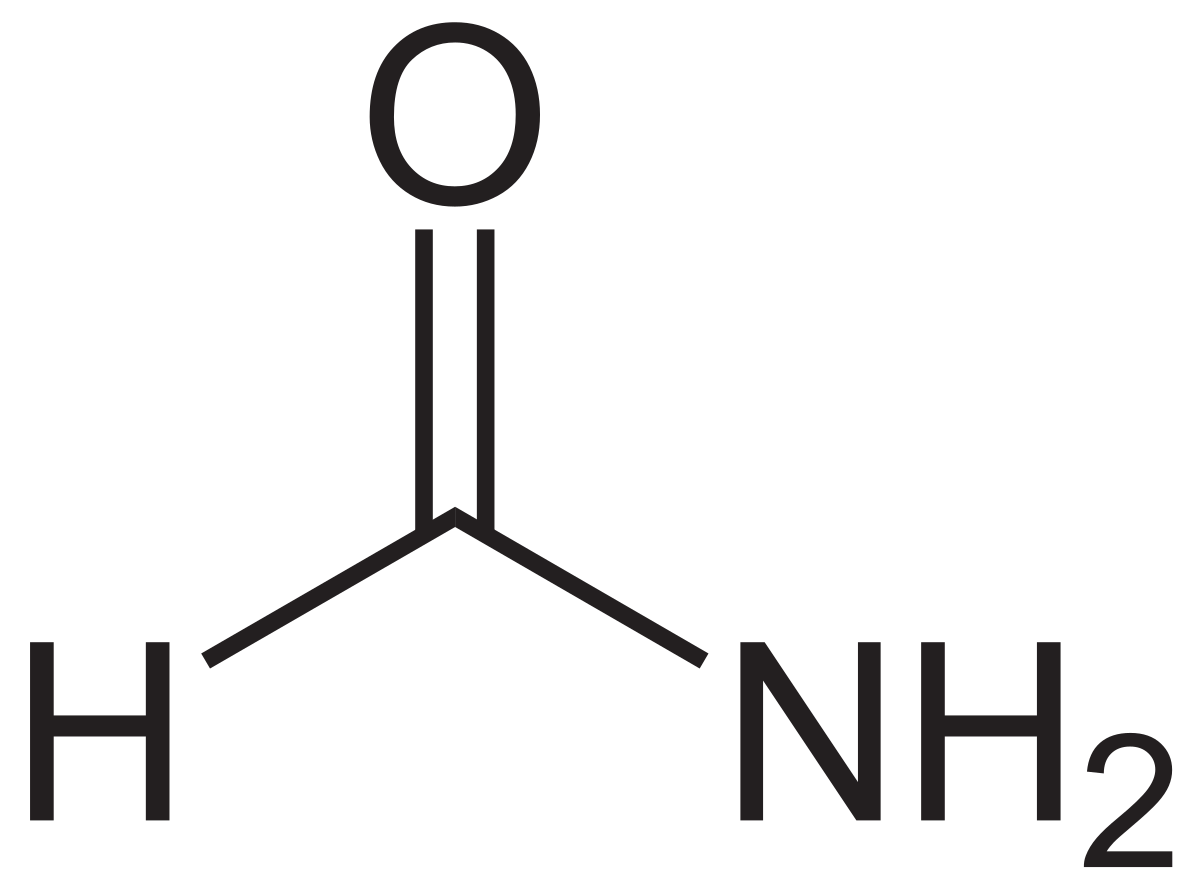
| ||
| Général | ||
| Nom IUPAC | ||
| Synonymes | méthanamide Carbamaldéhyde | |
| No CAS | ||
| No EINECS | ||
| SMILES | ||
| InChI | ||
| Apparence | liquide incolore, hygroscopique, visqueux. | |
| Propriétés chimiques | ||
| Formule brute | CH3NO | |
| Masse molaire | 45,0406 ± 0,0015 g·mol-1 | |
| pKa | 0,3 | |
| Moment dipolaire | 3,73 ± 0,07 D | |
| Diamètre moléculaire | 0,431 nm | |
| Propriétés physiques | ||
| T° fusion | 2,5 °C | |
| T° ébullition | (décomposition) : 210 °C | |
| Solubilité | dans l'eau : très bonne, bonne dans l'éthanol peu soluble dans les solvants polaires. | |
| Masse volumique | 1,1334 g·cm-3 | |
| T° d’auto-inflammation | >500 °C | |
| Point d’éclair | 154 °C (coupelle ouverte) | |
| Pression de vapeur saturante | à 20 °C : environ 2 Pa | |
| Thermochimie | ||
| Cp | ||
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 10,16 ± 0,06 eV (gaz) | |
| Propriétés optiques | ||
| Indice de réfraction |
| |
| Précautions | ||
| | ||
| ||
| Phrases R : 61, | ||
| Phrases S : 45, 53, | ||
| | ||
|
1 2 - | ||
| | ||
Le formamide est un amide provenant de l'acide formique. À température ambiante, il se présente comme un liquide incolore proche de la consistance de la glycérine. C'est un solvant hygroscopique et un réducteur d'odeur proche de celle de l'ammoniac. Il peut se transformer en acide cyanhydrique s'il est soumis à des températures supérieures à 90 °C. À des températures supérieures à 200 °C, le formamide se transforme en acide cyanhydrique, ammoniac, monoxyde de carbone et eau.
Données physiques complémentaires
densité de vapeur: 1,55 (air = 1)
pression de vaporisation: 0,08 mmHg (11 Pa) à 20 °C
point éclair: 154 °C
pKa: 23,5
Utilisations
Le formamide est utilisé dans les applications suivantes:
- synthèse des vitamines.
- acide prussique.
- acide cyanhydrique
- colles
- stabilisation des acides nucléiques
- Synthèse du 3,4-méthylènedioxyamphétamine (MDA)
Production
La réaction entre l'acide formique et l'ammoniac produit du formiate d'ammonium, lequel peut conduire sous l'action de la chaleur au formamide :
- HCOOH + NH3 → HCOONH4
- HCOONH4 → HCONH2 + H2O




















































