Fluorure d'hydrogène - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Fluorure d'hydrogène | |||
|---|---|---|---|
| |||
| Général | |||
| Nom IUPAC | |||
| No CAS | |||
| No EINECS | |||
| Apparence | gaz incolore ou liquide incolore, d'odeur acre. | ||
| Propriétés chimiques | |||
| Formule brute | HF | ||
| Masse molaire | 20,00634 ± 7,0E-5 g·mol-1 | ||
| Moment dipolaire | 1,826178 D | ||
| Diamètre moléculaire | 0,290 nm | ||
| Propriétés physiques | |||
| T° fusion | -83 °C | ||
| T° ébullition | 20 °C | ||
| Solubilité | dans l'eau : très bonne | ||
| Masse volumique | 1,0 g·cm-3 | ||
| T° d’auto-inflammation | ininflammable | ||
| Pression de vapeur saturante | à 25 °C : 122 kPa | ||
| Point critique | 64,8 bar, 187,85 °C | ||
| Thermochimie | |||
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 16,044 ± 0,003 eV (gaz) | ||
| Propriétés optiques | |||
| Indice de réfraction |
| ||
| Précautions | |||
| | |||
| |||
| Phrases R : 26/27/28, 35, | |||
| Phrases S : 1/2, 7/9, 26, 36/37/39, 45, | |||
| | |||
| |||
| | |||
|
0 4 1 | |||
| | |||


| |||
| | |||


Danger | |||
| Inhalation | Très toxique | ||
| Peau | Très corrosif, Très toxique | ||
| Yeux | Très corrosif | ||
| Ingestion | Très toxique | ||
| Écotoxicologie | |||
| Seuil de l’odorat | bas : 0,04 ppm | ||
| | |||
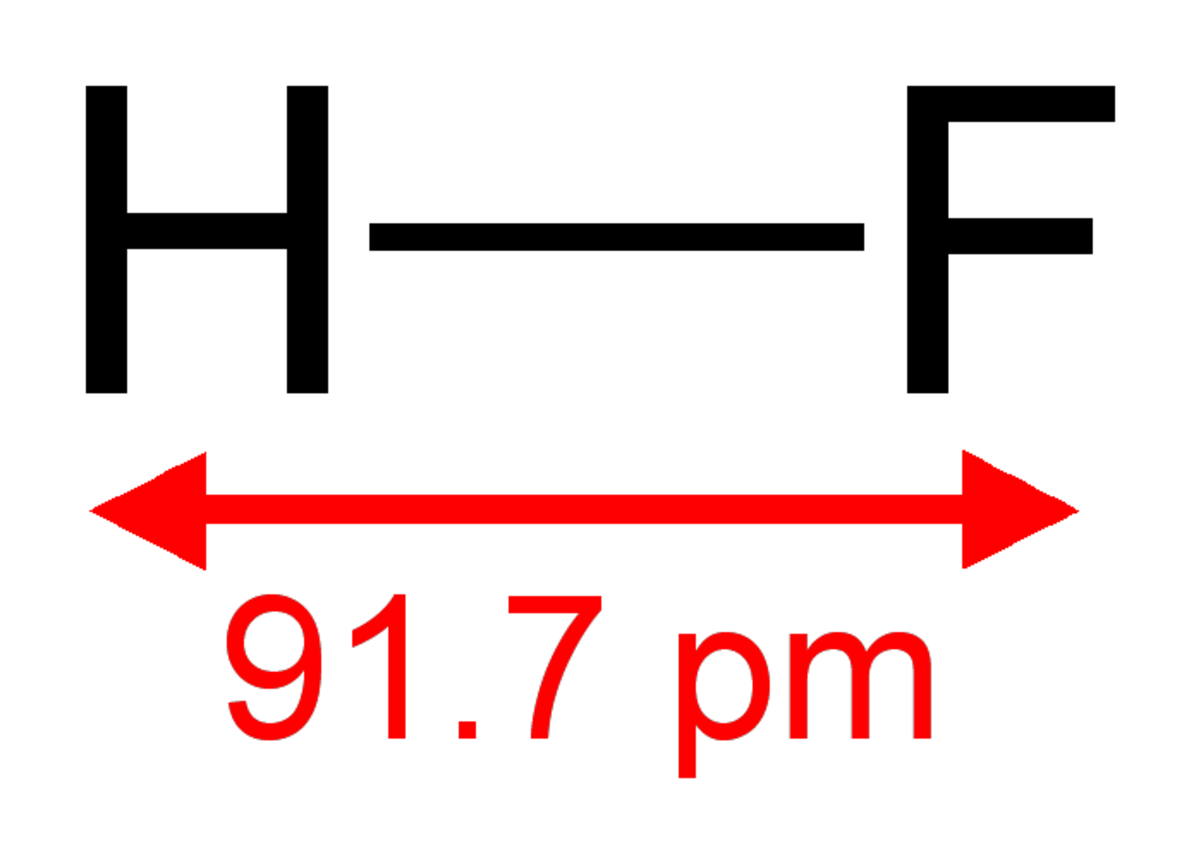
Le fluorure d'hydrogène est un gaz incolore de formule chimique HF (un atome d'hydrogène (H) et un atome de fluor (F)). Il a une odeur piquante, il est très corrosif et très facilement liquéfiable.
Théoriquement, le fluorure d'hydrogène devrait être un gaz difficilement liquéfiable or il est liquide à température ambiante. Cette anomalie est due au fait que le fluorure d'hydrogène se présente sous forme polymérisée (HF)2.
Chimie
La molécule de fluorure d’hydrogène HF est une molécule diatomique constituée d’un atome d’hydrogène H et d'un atome de fluor F, liés par une liaison simple. Le fluor étant nettement plus électronégatif que l’hydrogène, la liaison est très polarisée. En conséquence, la molécule porte un moment dipolaire important, avec une charge partielle négative δ- portée par l’atome de fluor et une charge partielle positive δ+ portée par l’atome d’hydrogène. Le fluorure d’hydrogène est donc une molécule polaire. Elle est très soluble dans l’eau et dans les solvants polaires. La dissolution du fluorure d'hydrogène dans l'eau est une réaction exothermique violente qui doit être réalisée avec précaution, car des projections peuvent avoir lieu.





















































