Ferrocène - Définition
La liste des auteurs de cet article est disponible ici.
Liaisons et structure
L'atome de fer dans le ferrocène est à l'état d'oxydation +2. Chaque cycle pentadiènyle est donc chargé une fois négativement, amenant le nombre d'électrons π à six sur chaque cycles. Ils sont donc aromatiques. Ces douze électrons - six pour chaque cyle - forment des liaisons covalentes avec le métal. Ajoutés aux six électrons de la couche d du fer, le complexe complait à la règle des 18 électrons. La distance des laisons carbone-carbone des cycles est de 1,40 Å. Les liaions Fer - carbone font 2,04 Å.
Propriétés Chimiques
Réaction avec les électrophiles
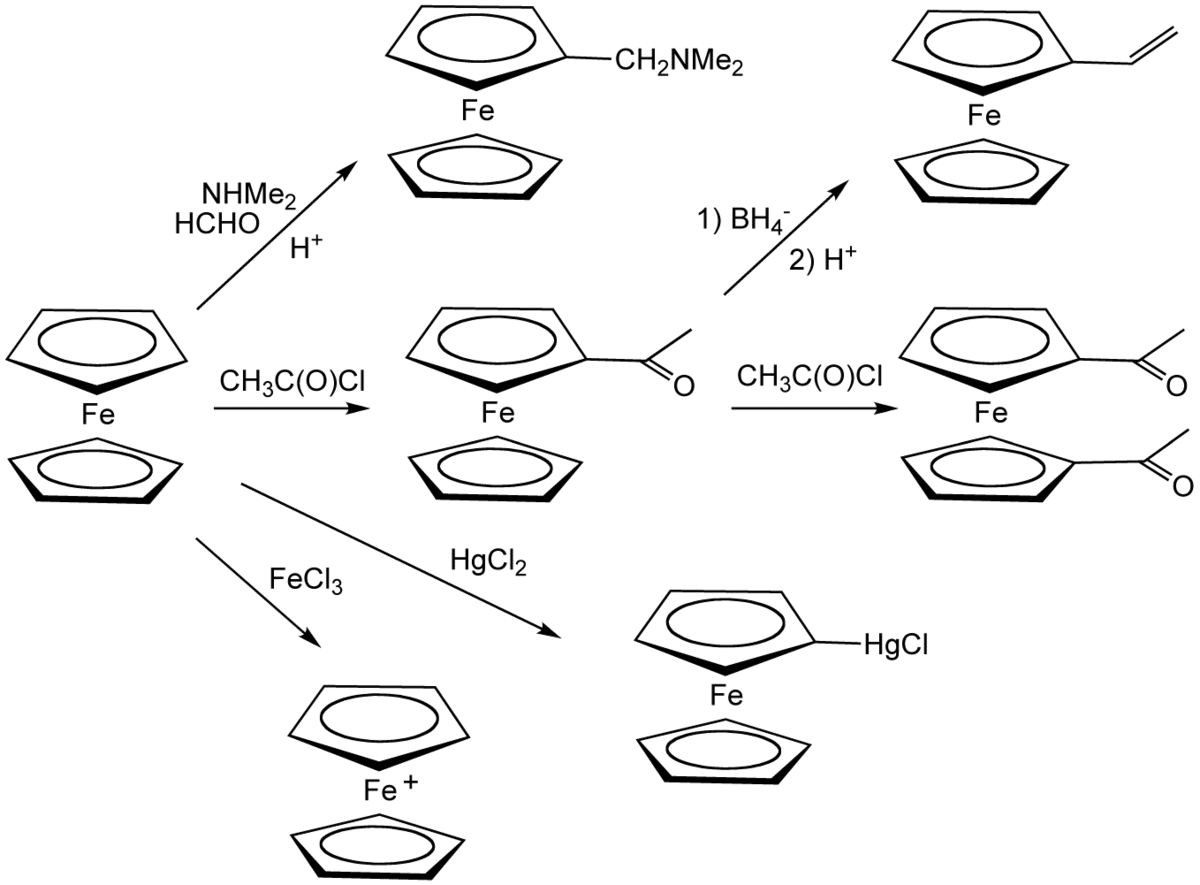
Le ferrocène se comporte comme la plupart des aromatiques, permettant la synthèse de dérivés substitués. Une expérience classique de démonstration est une réaction de Friedel-Crafts avec l'anhydride acétique en présence d'acide phosphorique comme catalyseur. En présence de chlorure d'aluminium, Me2NPCl2 et le ferrocène réagissent pour donner la ferrocenyl dichlorophosphine, alors que le traitement avec la phenyldichlorophosphine dans les mêmes conditions conduit à la P,P-diferrocenyl-P-phenyl phosphine.
Lithiation
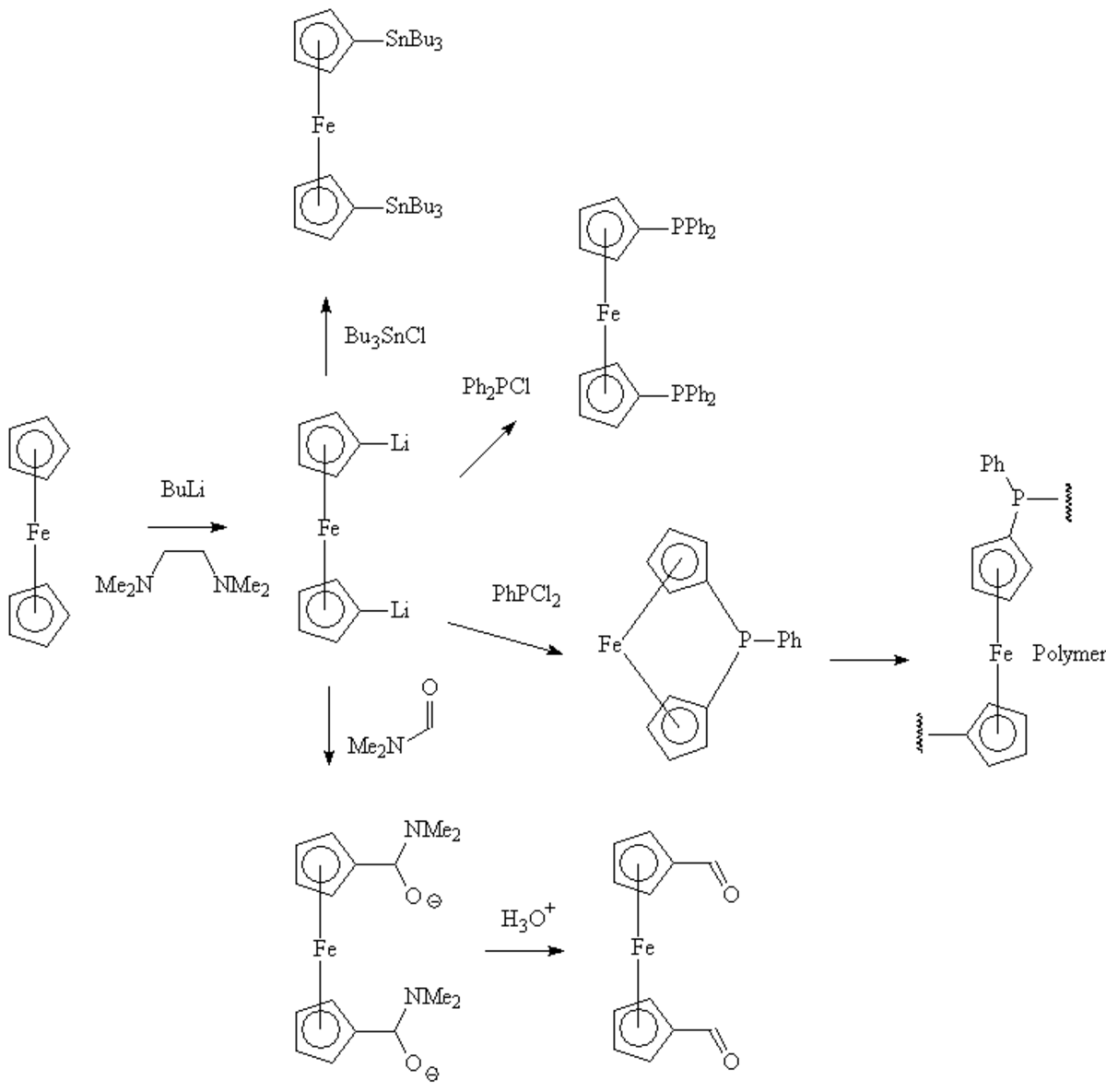
Le ferrocène réagit facilement avec le butyllithium pour donner le 1,1'-dilithioferrocene, qui est un nucléophile polyvalent. Il peut réagir avec le diethyldithiocarbamate de sélénium pour donner un ferrocenophane dans lequel les deux cycles pentadiènyles sont liés par l'atome de sélénium. Ce ferrocephane peut être converti en un polymère par une réaction de polymérisation par ouverture de cycle et former des poly(ferrocenyl sélénide). De même, en mettant en jeu des ferrocenophanes liés par un atome de silicium ou de phosphore, on peut obtenir les polymères correspondants (poly(ferrocenylsilane)s et poly(ferrocenylphosphines)s).
Oxydoréduction
Contrairement à la majorité des hydrocarbures, le ferrocène peut être oxydé une fois à faible potentiel, environ 0,5V par une électrode au calomel. L'oxydation du ferrocène donne un ion stable appelé ferrocénium. A l'échelle préparative, l'oxydation peut se faire par ajout de FeCl3 pour donner un ion bleu, [Fe(C5H5)2]+. A défaut, le nitrate d'argent peut aussi être utilisé comme oxydant.
Les sels de ferrocenium sont parfois utilisés comme oxydants, principalement pour l'inertie de ferrocène, et sa facilité à être séparé de produits ioniques.. L'ajout de substituants sur les cycles pentadiènyles altère le potentiel redox : les groupements attracteurs d'électrons comme les acide carboxyliques déplace le potentiel vers l'anode (donc le rend plus positif), alors que les groupements donneurs comme le méthyle le rend plus négatif. Ainsi, la décaméthylferrocène est beaucoup plus facile à oxyder que le ferrocène. Ce dernier est souvent utilisé comme étalon interne pour calibrer les potentiels rédox en électrochimie des milieux non-aqueux.