Fer - Définition
La liste des auteurs de cet article est disponible ici.
Histoire de la métallurgie du fer
Le fer était connu dès le chalcolithique à travers les météorites ferreuses, et sa métallurgie demeura très confidentielle jusqu'au XIIe siècle av. J.-C., époque qui marque, précisément, le début de « l'Âge du fer » : les Hittites, en Anatolie, avaient développé une assez bonne maîtrise du travail du fer autour du XVe siècle av. J.-C., dont leur tradition attribuait l'origine dans la région du Caucase, et cette technique semble également avoir été connue assez tôt en Inde du nord, notamment dans l'Uttar Pradesh. Jusqu'au Moyen Âge, l'Europe raffina le fer au moyen de bas fourneaux, qui ne produisent pas de fonte ; la technique du haut fourneau, qui, elle, produit de la fonte brute à partir de charbon de bois et de minerai de fer, a été mise au point en Chine au milieu du Ve siècle av. J.-C. et a donc mis plus d'un millier d'années à diffuser jusqu'en Occident.
Occurrence et gisements
Le fer est le 6e élément le plus abondant dans l'Univers, il est formé comme « élément final » de fusion nucléaire, par fusion du silicium dans les étoiles massives. Tandis qu'il compose environ 5 % (en masse) de la croûte terrestre, le noyau terrestre est censé être en grande partie un alliage de fer-nickel, constituant ainsi 35 % de la masse de la Terre dans son ensemble ! Le fer est peut-être, en fait, l'élément le plus abondant sur Terre ou du moins comparable (en juste 2e position) en masse à l'oxygène, mais seulement le 4e le plus abondant dans la croûte terrestre.
La majeure partie du fer dans la croûte est combinée avec l'oxygène, formant des minerais d'oxyde de fer, tels que l'hématite (FeO), la magnétite (FeO) et la limonite (FeO.nHO).
L'oxyde magnétique ou magnétite FeO est connu depuis l'Antiquité grecque. Il tire son nom du mont Magnetos (le grand mont), une montagne grecque particulièrement riche en ce minéral.
Environ 1 météorite sur 20 comprennent de la taenite unique alliage de minéral de fer-nickel (fer 35-80 %) et la kamacite (fer 90-95 %). Bien que rares, les météorites de fer sont la forme principale de fer natif (métallique) sur la surface terrestre.
La couleur rouge de la surface de Mars est due à un régolithe riche en oxyde de fer. la « planète rouge » est en quelque sorte une « planète rouillée ».
Propriétés
Propriétés physiques
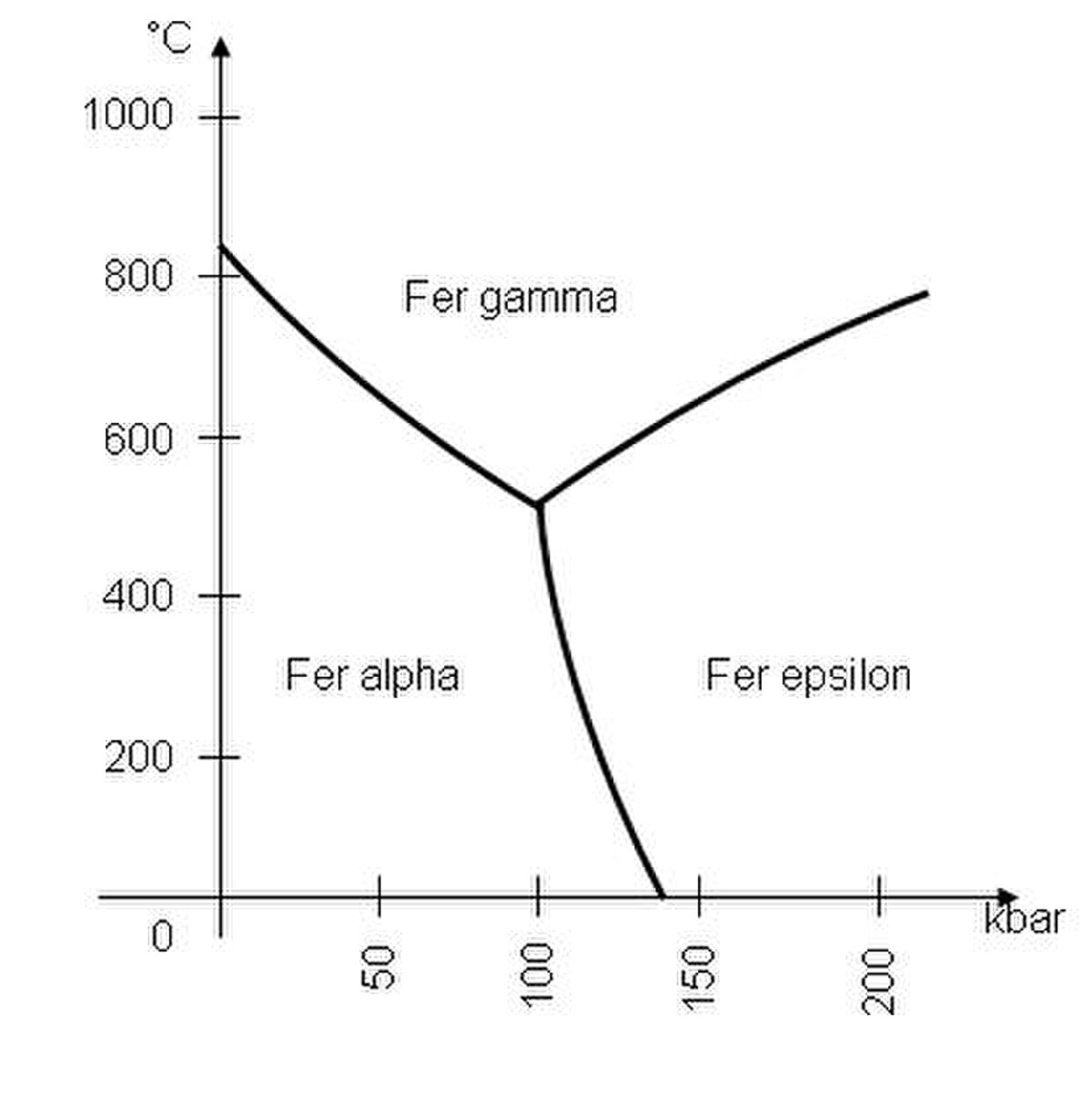
C'est un métal qui, en fonction de la température, se présente sous plusieurs formes allotropiques :
- Dans les conditions normales de pression et de température, c'est un solide cristallin de structure cubique centré (fer α ou ferrite).
- À partir de 912 °C, il devient cubique à faces centrées (fer γ ou austénite).
- Au-delà de 1 394 °C, il redevient cubique centré (fer δ).
- Il fond à 1 535 °C.
- La transformation en fer ε (structure hexagonale compacte)[réf. souhaitée] ne se rencontre qu'à des pressions supérieures à 110 kilobars.
Sa capacité calorifique est de 0,5 kJ/kg/°C.
Le fer est ferromagnétique : les moments magnétiques des atomes s'alignent sous l'influence d'un champ magnétique extérieur et conservent leur nouvelle orientation après la disparition de ce champ.
Des courants de convection dans la couche externe du noyau terrestre (noyau externe), de « l'alliage » liquide principalement fer-nickel, sont supposés être à l'origine du champ magnétique terrestre.
S'il est exposé à l'air libre ou mis dans l'eau salée, il rouille et s'il n'est pas entretenu, il va progressivement se dégrader jusqu'à ce que plus rien ne reste de son état solide naturel.
Il a une dureté entre 4 et 5 sur l'échelle de mohs.
Propriétés chimiques

Le fer,combiné à l'oxygène, forme trois oxydes : FeO (oxyde ferreux), FeO (oxyde ferrique),FeO (oxyde magnétique).
A l'air libre en présence d'humidité, il se corrode en formant de la rouille FeO ,n(HO). La rouille étant un matériau poreux, la réaction d'oxydation peut se propager jusqu'au cœur du métal, contrairement, par exemple, à l'aluminium, qui forme une couche fine d'oxyde imperméable.
En solution, il présente deux valences principales :
- Fe2+ (le fer ferreux) qui présente une faible couleur verte ;
- Fe3+ (le fer ferrique) qui possède une couleur rouille caractéristique. Fe3+ peut être réduit par du cuivre métallique, par exemple, réaction à l'origine du procédé de gravure des circuits imprimés par le trichlorure de fer, FeCl3.
L'hémoglobine du sang, qui permet aux globules rouges de transporter le dioxygène, contient du fer.
Propriétés nucléaires
Le noyau de fer 56 possède la masse par nucléon la plus faible de tous les nucléides mais pas l'énergie de liaison la plus élevée, en raison d'une proportion de protons un peu plus élevée que le nickel 62 qui, lui, a l'énergie de liaison la plus élevée par nucléon.
Le fer 56 résulte de la désintégration naturelle du nickel 56, isotope instable produit au cœur d'étoiles massives par fusion du silicium 28 au cours de réactions alpha en cascade qui s'arrêtent au nickel précisément parce que ce dernier possède l'énergie de liaison nucléaire par nucléon la plus élevée : poursuivre la fusion, pour produire par exemple du zinc 60, consommerait de l'énergie au lieu d'en libérer.


















































